Физика допплерографии
Физические основы допплерографии
Л. В. Осипов (CD 1999 г)
- Эффект Допплера
- Движущийся приемник звука
- Движущийся источник звука
- Движущийся отражатель ультразвука
- Допплеровский сдвиг частоты. Допплеровский угол
- Частота излучаемого сигнала
- Понятие о спектре скоростей кровотока
- Непрерывноволновой допплер
- >Импульсноволновой допплер
- Сигналы и их спектры
- Измерение спектра частот допплеровского сдвига. Однозначность измерения
- Практические измерения и вычисления в режиме спектральной допплеровской эхографии
- Цветовое допплеровское картирование
- Практика работы в режиме цветового допплеровского картирования
- Развитие допплеровских методов
- Литература
Ультразвуковые допплеровские методы являются эффективным средством неинвазивного исследования характеристик движения тканей в организме человека и широко применяются в кардиологии и сосудистой диагностике. Рассматриваемые методы бурно развиваются, поэтому терминология в этой области еще не устоялась. Кроме того, конкуренция между фирмами-производителями приводит к тому, что близкие или по сути одинаковые технологии (методики) в разных фирменных руководствах, рекламных проспектах: и даже в научных публикациях имеют разные названия. Для русскоязычного читателя проблема усугубляется тем, что в этой области сформировался определенный англо-американский жаргон, который де-факто приобрел "права гражданства". Например, вместо термина "допплеровская эхография", или "допплерография", обычно употребляется просто допплер ('Doppler'). К сожалению, такой жаргон получил настолько широкое распространение, что сейчас не представляется возможным кардинально улучшить ситуацию. Поэтому и в предыдущих томах данного руководства мы были вынуждены, например, согласиться с использованием термина "энергетический допплер"; по этой же причине мы в дальнейшем будем пользоваться терминами "спектральный допплер" и т.п. При этом читатель, разумеется, должен отдавать себе отчет в том, что "допплер" это не ошибочное написание фамилии Допплер, а сокращенное, точнее жаргонное, обозначение термина "допплеровская эхография".
Можно ввести следующую классификацию допплеровских методов в зависимости от способов получения и отображения информации.
- Метод оценки изменения во времени скорости кровотока в сечении сосуда или части сечения сердца, сосуда.
- Метод оценки ЧСС (частоты сердечных сокращений) с использованием допплеровского эффекта.
- Спектральная допплеровская эхография, или кратко — спектральный допплер (D-режим, или spectral Doppler) — оценка спектра скоростей кровотока в сердце и сосудах в процессе его изменения во времени.
- Методы цветовой допплер о в скоп эхографии, к которым прежде всего относится цветовое допплеровское картирование кровотока (режим CFM — color flow mapping) — двухмерное изображение биологических структур, в котором скорость движения отдельных элементов отображается с помощью цвета различных оттенков.
В качестве разновидностей цветовой допплеровской эхографии используются следующие методы:
- энергетический допплер (PD — power Doppler);
- допплеровская визуализация тканей (DTI — Doppler tissue imaging);
- конвергентный цветовой допплер (CCD — convergent color Doppler).
Приборы, оценивающие скорость кровотока, являются наиболее простыми из допплеровских приборов. В настоящее время они практически не применяются, а метод оценки скорости (средней или максимальной) используется как один из режимов в более совершенных приборах спектральной допплерографии.
Метод допплеровской оценки ЧСС в силу простоты и эффективности находит широкое применение при исследовании ЧСС плода в фетальных мониторах.
Чаще всего в настоящее время применяются методы спектрального допплера и цветового допплеровского картирования.
В ультразвуковых сканерах перечисленные методы, как правило, используются вместе с другими известными методами представления информации, такими как:
- >В-режим — обычный метод двухмерной эхографии с серошкальным изображением, получаемым в процессе ультразвукового сканирования;
- М-режим — метод оценки движения биологических структур по изменению во времени одномерной ультразвуковой зхограммы (получаемой в одном луче без сканирования).
Ультразвуковые приборы, в которых используется только режим спектрального допплера и отсутствует В-режим, иногда называют приборами "слепого" допплера.
Ультразвуковые сканеры, в которых наряду с В-режимом применяется спектральный допплер (D-режим), называются дуплексными приборами. Режим отображения на экране сканера одновременно В- и D-эхограмм называется дуплексным режимом В+D.
Если в приборе одновременно применяются режимы В, CFM и D, то такой режим В+CFM+D называется триплексным.
Эффект Допплера
Основой допплеровских методов является эффект Допплера, который состоит в том, что частота колебаний звуковых волн, излучаемых источником (передатчиком) звука, и частота этих же звуковых волн, принимаемых некоторым приемником звука, отличаются если приемник и передатчик движутся друг относительно друга (сближаются или удаляются). Тот же эффект наблюдается, если в приемник поступают сигналы источника звука после отражения движущимся отражателем. Зтот последний случай имеет место при отражении ультразвуковых сигналов от движущихся биологических структур (например, клеточных элементов крови).
Поясним эффект Допплера на примерах, в которых для простоты будем считать, что источник звука излучает колебания одного тона (одной частоты).
Движущийся приемник звука
Источник звука неподвижен, приемник движется со скоростью vnp по отношению к источнику (рис. 1.а). Если бы приемник был неподвижен относительно источника, на него приходили бы колебания с частотой f0, равной частоте излучения (рис. 1.б). На рис. 1а эти колебания условно изображены в виде дуг окружности увеличивающегося радиуса. Эти дуги обозначают положения пиков волн в пространстве в фиксированный момент времени. Расстояния между соседними дугами равны длине звуковой волны λ0. Пики волн движутся по направлению к приемнику со скоростью звука С.
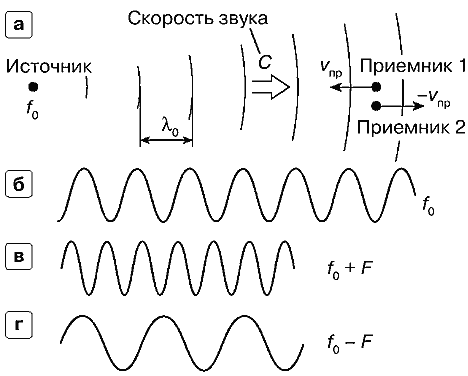
Рис. 1. Эффект Допплера при движении приемника,
a — приемник 1 движется к источнику со скоростью vnp, приемник 2 движется от источника со скоростью vпр.б — колебания, излучаемые источником с частотой f0.
в — колебания в приемнике 1— частота f0+F.
г — колебания в приемнике 2 — частота f0–F.
При движении приемника по направлению к источнику со скоростью vпр (приемник 1 на рис. 1.а) взаимная скорость сближения пиков волн и приемника увеличивается по сравнению со скоростью звука и становится равной С + vпр. Очевидно, что и частота колебаний на входе приемника увеличивается пропорционально росту скорости и становится равной: <nobr>f = f0(C + vnp)/C=f0 + F</nobr>
На рис. 1.в показан вид колебания с этой частотой, большей частоты источника на величину дополнительного сдвига частоты
| F = f0vnp/C | (1) |
|---|
При движении приемника по направлению от источника со скоростью (–vnp) (приемник 2 на рис. 1.а) скорость пиков волн относительно приемника уменьшается по сравнению со скоростью звука и становится равной С–vnp. Частота колебаний на входе приемника в этом случае равна
f = f0(C – vnp)/C = f0 – FНа рис. 1.г показан вид колебания с этой частотой, которая отличается от частоты источника на величину того же частотного сдвига, но с отрицательным знаком.
Движущийся источник звука
Рассмотрим теперь случай, когда приемник неподвижен и движется источник (рис. 2). Если источник движется по направлению к приемнику со скоростью vист, расстояния между соседними пиками волн уменьшаются, т.е. уменьшается в этом направлении длина волны λ в соответствии с выражением
λ = λ0(C – vист)/C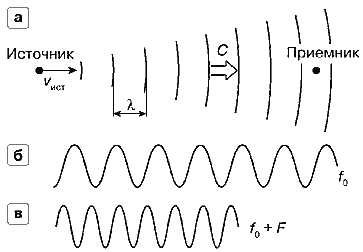
Рис. 2. Эффект Допплера при движении источника,
а — источник движется к приемнику со скоростью vист.б — колебания источника - частота f0.
в — колебания в приемнике - частота f0+F
Используя известное соотношение λ = C/f, можно написать выражение для частоты колебаний на входе приемника, которая становится больше, чем частота источника:
λ = λ0С/(C – vист) = λ0 + FНа рис. 2.в показан вид колебания на входе приемника с частотой, большей, чем частота источника, на величину частотного сдвига
| F = f0vист/(C – vист) | (2) |
|---|
Если источник движется в противоположном направлении от приемника, тс частота на входе приемника уменьшается:
f = f0C/(C + vист) = f0 – Fгде частота сдвига| F = f0vист/(C + vист) | (3) |
|---|
Движущийся отражатель ультразвука
В медицинских ультразвуковых приборах источник и приемник сигналов объединены в датчике прибора, т.е. излучение и прием сигналов происходит в одном месте. При излучении ультразвука внутрь биологических структур ультразвук отражается и рассеивается на их неоднородностях. Эхо-сигналы, отражаемые в сторону датчика, принимаются находящимся в датчике ультразвуковым преобразователем, который является приемником эхо-сигналов. Если наблюдаемые биологические структуры неподвижны, эхо-сигналы от них не имеют частотного сдвига. В случае же движения биологических структур в эхо-сигналах появляется частотный сдвиг, изменяющий значение частоты эхо-сигнала по сравнению с частотой излучаемого ультразвукового сигнала.
На рис. 3 схематически изображены совмещенные источник и приемник ультразвука и отражатель, движущийся в сторону источника и приемника со скоростью v. Колебания, приходящие от источника на движущийся отражатель, имеют такой же вид, как и в первом рассмотренном нами случае "движущийся приемник звука". Частота колебаний на отражателе
fотр = f0(C + v)/C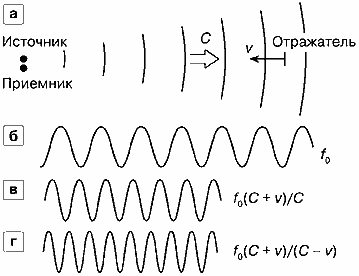
Рис. 3. Эффект Допплера при движении отражателя,
а — источник и приемник совмещены и неподвижны, отражатель движется к ним со скоростью v.б — колебания источника с частотой f0.
в — колебания, приходящее на отражатель,
г — колебания в приемнике.
Отражая эти колебания в сторону приемника, отражатель выступает в роли источника, поэтому приходящие от него к приемнику колебания имеют частоту
f=fотрC/(C – v)аналогично тому, как это было во втором случае "движущийся источник звука".В результате частота эхо-сигналов на входе приемника определяется выражением
| f = f0 | C + v | × | C | = f0 | C + v | (4) |
|---|---|---|---|---|---|---|
| C | C – v | C – v |
Очевидно, если отражатель движется в сторону, противоположную от источника и приемника, выражение для частоты на входе приемника изменяется:
| f = f0 | C – v | (5) |
|---|---|---|
| C + v |
Допплеровский сдвиг частоты. Допплеровский угол
В ультразвуковых диагностических приборах определяется не сама частота колебания, поступающего в приемник, а разность этой частоты f и частоты f0 — колебания, излучаемого источником. Эта разность называется допплеровским сдвигом частоты Fд. Для случая движения отражателя в сторону датчика его можно вычислить следующим образом:
| Fд = f – f0 = f0 | C + v | – f0 = f0 | 2v | (6) |
|---|---|---|---|---|
| C – v | C – v |
Скорость движения биологических структур (например, кровотока) не превышает, как правило, нескольких метров в секунду. Скорость звука С в мягких биологических тканях в среднем равна 1540 м/с. Поэтому можно принять, что v < С, т.е. скорость движения структур существенно меньше скорости звука. Тогда выражение для допплеровского сдвига Fд имеет вид
| Fд = 2f0v/C | (7) |
|---|
Когда отражатель движется к датчику, допплеровский сдвиг положителен. Если отражатель движется в противоположную от датчика сторону со скоростью (–v), то допплеровский сдвиг отрицателен.
В вышерассмотренных примерах предполагалось, что отражатель движется вдоль направления на датчик (по оси датчика, а точнее, вдоль оси ультразвукового луча). В общем случае движение отражающих структур может происходить в произвольном направлении, т.е. вектор скорости движения может быть направлен под некоторым углом α относительно направления на датчик (рис. 4). Допплеровский сдвиг частоты определяется проекцией скорости v на линию, соединяющую отражатель с датчиком, т.е. величиной v·cosα. Следовательно, выражение для допплеровского сдвига частоты должно иметь вид
| Fд = 2f0v·cosα/C | (8) |
|---|
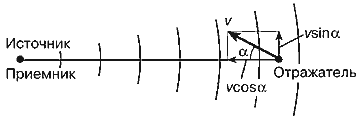
Рис. 4. Учет допплеровского угла а между направлением движения отражателя и направлением на источник-приемник.
Это основное соотношение, позволяющее по измеренному в приборе допплеровскому сдвигу частоты Fд оценивать скорость движения v.
Действительно, частота f0 колебаний, излучаемых датчиком, известна. Скорость звука в большинстве мягких тканей изменяется в пределах ±5% относительно среднего значения С = 1540 м/с, поэтому в расчетах может быть принято это значение. Величина угла α, вообще говоря, неизвестна, но во многих случаях может быть оценена. Например, с помощью обычного ультразвукового сканирования можно определить по В-эхограмме ориентацию сосуда и, следовательно, угол α, между направлением кровотока и направлением на допплеровский датчик. Угол α обычно называют допплеровским углом.
Иногда врачу не требуется точно определять скорость v и достаточно оценивать по допплеровскому сдвигу частоты проекцию скорости v·cosα и изменение ее во времени. При этом врач может грубо оценить угол а, используя зависимость величины допплеровского сдвига частоты Fд от угла α.
Проиллюстрируем сказанное с помощью рис. 5, на котором показаны различные случаи ориентации оси допплеровского датчика относительно оси кровеносного сосуда. На рис. 5.а дан случай, когда оси датчика и сосуда перпендикулярны друг другу: угол α = 90° и cosα = 0. В этом случае допплеровский сдвиг Рд = 0, и оценить скорость кровотока невозможно. Однако достаточно наклонить ось датчика относительно сосуда так, чтобы угол α между ними отличался от 90°, и сразу появляется возможность оценки скорости кровотока, так как Fд = 0.
На рис. 5.б допплеровский сдвиг Рд положителен (cosα > 0), однако, если наклонить ось датчика в другом направлении (рис. 5.в), сдвиг Fд — отрицателен (cosα < 0).
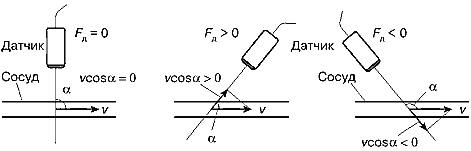
Рис. 5. Зависимость допплеровского сдвига частоты Fд от угла α между осью ультразвукового датчика и направлением кровотока.
При малых отклонениях от положения α = 90° величина проекции скорости v·cosα мала и, следовательно, относительно мала величина допплеровского сдвига Fд. При этом точность оценки скорости кровотока также мала. Для увеличения точности полезно ориентировать датчик так, чтобы уменьшить угол α. Однако при этом следует иметь в виду чрезвычайно важное обстоятельство — при уменьшении угла α менее 25° или увеличении угла более 155° (так называемые критические углы) ультразвук может не проходить через границу между стенкой сосуда и кровью, а полностью отражаться от этой границы. Этот эффект необходимо учитывать при наблюдении кровотока в сосудах.
Мы рассматривали и иллюстрировали примерами оценку скорости кровотока в предположении постоянства скорости движения отражателей. На самом деле скорость движения биологических структур меняется во времени. Так, скорость кровотока в артериях периодически меняется в соответствии с циклами сердечных сокращений. Поэтому и частота допплеровского сдвига также меняется во времени. Это означает, что если мы хотим исследовать характер изменения скорости кровотока во времени, необходимо достаточно часто проводить измерения допплеровского сдвига. Например, если ЧСС составляет 150 в минуту, то период (цикл) работы сердца составляет Тс = 0,4 с. Для того чтобы отследить все изменения скорости кровотока в различных фазах сердечного цикла (систолической и диастолической), надо в течение периода Тс иметь по крайней мере 10 измерений через равные промежутки времени. Это значит, что измерения надо проводить с интервалом не более Тс /10, или 0,04 с, т.е. с частотой повторения не менее 25 с–1. В этом случае выполняется требование измерения в реальном времени.
Частота излучаемого сигнала
Из выражения для допплеровского сдвига частоты (8) видно, что при неизменной скорости кровотока Допплеровский сдвиг пропорционален частоте излучаемого датчиком сигнала: чем больше эта частота, тем больше сдвиг. По этой причине целесообразно выбирать как можно большую величину частоты сигнала, так как при этом увеличивается точность измерения допплеровского сдвига Рд и, следовательно, точность оценки скорости v в каждый момент времени.
Стремление увеличить частоту излучения, к сожалению, в существенной мере сдерживается физическими ограничениями, связанными с затуханием ультразвуковых колебаний в биологических тканях. Как известно, эти затухания имеют частотнозависимый характер, т.е. с увеличением частоты повышается степень затухания и, следовательно, уменьшается максимальная глубина, на которой еще можно получить эхо-сигнал приемлемого уровня, достаточного для измерения допплеровского сдвига частоты.
Уровень эхо-сигналов, отраженных форменными элементами крови, прежде всего эритроцитами, в среднем ниже, чем уровень эхо-сигналов, отраженных неоднородностями мягких тканей, что обусловлено очень малым размером эритроцитов. Поэтому для получения необходимого уровня эхо-сигналов в заданном диапазоне глубин в допплеровских режимах применяются несколько более низкие частоты, чем в В-режиме.
В чисто допплеровских режимах (без одновременного получения В-изображения) используются, как правило, датчики со следующими частотами:
- 2 МГц — для исследования сосудов мозга (транскраниального исследования);
- 3 МГц — для исследования плацентарного кровотока;
- 4 или 5 МГц — для исследования относительно крупных и глубоко расположенных сосудов;
- 8 или 10 МГц — для исследования мелких, неглубоко расположенных периферических сосудов.
В так называемых дуплексных датчиках, используемых для получения одновременно двухмерного В-изображения и допплеровских измерений, частота для допплеровских измерений ниже, чем частота для В-режима. Например, датчик с частотой 3,5 МГц в В-режиме в допплеровском режиме излучает частоту 3 МГц, в датчике с частотой 5 МГц (в В-режиме) в допплеровском режиме применяется частота 4 МГц.
Вернемся опять к формуле (8) для допплеровского сдвига частоты, исключив из нее для простоты зависимость от угла α (7):
| Fд = 2f0v/C |
|---|
Если подставить в нее значение скорости v = 2 м/с, то для частоты излучения f0 = 8 МГц можно получить (имея в виду, что С ≈ 1540 м/с) сдвиг частоты Рд = 16 кГц. Для других, меньших значений скорости Допплеровский сдвиг частоты будет соответственно меньше. Полученный результат интересен тем, что имеет важное практическое значение. Вспомним, что диапазон частот, слышимых человеческим ухом, составляет от 20 Гц до 20 кГц. Поэтому с помощью специальных усилителей и акустических систем Допплеровский сдвиг частоты можно сделать слышимым, что делается практически во всех современных приборах с допплеровскими режимами работы. Возможность слышать допплеровские частоты помимо их наблюдения на экране прибора является очень полезной функцией, так как человеческое ухо — чувствительный и тонкий анализатор частот.
Понятие о спектре скоростей кровотока
Ранее мы предполагали, что наблюдаются отражатели, у которых скорость движения в данный момент времени одна и та же. На самом деле различные движущиеся отражатели имеют, как правило, различную скорость. Рассмотрим в качестве примера сечение сосуда (рис. 6). Скорость кровотока в центре сосуда максимальна и снижается по мере приближения к краям вследствие трения о стенки сосуда. В нормальном сосуде небольшого диаметра огибающая скоростей (кривая на рис. 6) имеет форму, близкую к параболе.
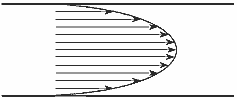
Рис. 6. Параболическое распределение скоростей кровотока в сечении сосуда.
Распределение скоростей на рис. 6 соответствует определенному моменту времени, в зависимости от времени величины скоростей будут меняться, хотя характер изменения скорости в сечении сосуда будет примерно тем же. В систолической фазе скорости в артериях существенно выше, чем в диастолической фазе.
Можно изобразить на графике (рис. 7) распределение скоростей в определенный момент времени, откладывая по горизонтальной оси значение скоростей, а по вертикальной оси — уровни эхо-сигналов, соответствующие каждому значению скорости. Чем большее количество элементов крови движется с определенной скоростью, тем больше уровень суммарного эхо-сигнала для этого значения скорости. Приведенное распределение амплитуд эхо-сигналов для различных скоростей называется спектром скоростей. Естественно, вид спектра скоростей меняется в различных фазах сердечного цикла — в систолической фазе он смещен в сторону более высоких значений скоростей (рис. 7а), в диастолической фазе спектр скоростей смещается к более низким значениям скоростей (рис. 7б).
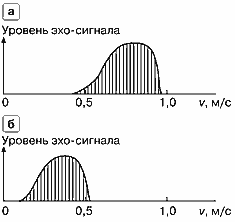
Рис. 7. Спектр скоростей в сечении сосуда,
а — в систолической фазе, б — в диастолической фазе.
Следует сказать о том, что спектр скоростей кровотока отображается на экране ультразвукового прибора не в виде амплитудного распределения, как на рис. 7, а в виде вертикальной линии, яркость каждой точки которой пропорциональна амплитуде сигнала на соответствующей скорости. Об этом будет сказано ниже более подробно.
Скорости кровотока, а точнее проекции скоростей на ось ультразвукового луча, формируемого датчиком, однозначно связаны с частотами допплеровского сдвига Рд согласно вышеприведенным формулам. Поэтому спектру скоростей кровотока соответствует спектр частот допплеровского сдвига. На рис. 8 изображен вид такого спектра частот для систолической и диастолической фаз. Подробнее о спектре частот допплеровского сдвига будет сказано в следующих разделах.
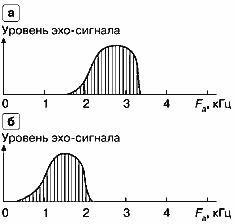
Рис. 8. Спектр частот допплеровского сдвига для эхо-сигналов,
а — в систолической фазе, б — в диастолической фазе.
Форма спектра скоростей в существенной мере зависит от характера кровотока в сосуде. На рис. 7 изображен вид спектра скоростей для нормального сосуда относительно небольшого диаметра с параболическим профилем скоростей в сечении. В сосуде большого диаметра, например в аорте, профиль скоростей отличается от параболического — в средней части сосуда большое количество эритроцитов движется с одинаковой скоростью (рис. 9.а). В этом случае спектр скоростей более узкий, чем в предыдущем случае.
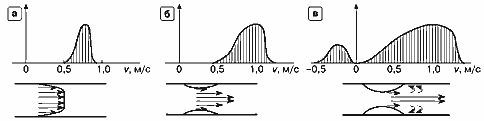
Рис. 9. Спектр скоростей в сосудах,
а — уменьшение ширины спектра в широком сосуде,
б — увеличение максимальной скорости и расширение спектра в зоне стеноза,
в — значительное расширение спектра и появление составляющих с обратной скоростью в зоне сильного стеноза.
Наличие стеноза в сосуде (рис. 9.б) приводит к увеличению максимальной скорости в центре сосуда (в систолической фазе). Кроме того, вследствие увеличения трения на границах сосуда в зоне стеноза увеличивается количество элементов крови, скорость которых замедляется. По этим причинам спектр скоростей в зоне стеноза более широкий, чем в нормальном сосуде.
В зоне сильного стеноза (рис. 9.в) максимальная скорость кровотока в систолической фазе еще больше увеличивается по сравнению с сосудом в норме. Количество составляющих с малыми скоростями также увеличивается, что приводит к дальнейшему расширению спектра. Кроме того, в области непосредственно после сужения сосуда, когда сосуд опять начинает расширяться, возникают завихрения кровотока, т.е. нарушение равномерности (ламинарности) кровотока: кровоток из ламинарного становится турбулентным. В спектре скоростей при этом могут появляться составляющие с противоположной (в данном случае отрицательной) скоростью.
Приведенные примеры показывают, что возможность получения информации о форме спектра скоростей кровотока в различных сечениях сосуда является исключительно полезной для диагностики сосудистых заболеваний. Очевидно, более полную информацию о состоянии сосудов может дать анализ изменения спектра скоростей во времени в различных фазах сердечного цикла.
На спектр скоростей кровотока влияют не только аномалии сосуда, но и геометрия сосуда и физические особенности процесса получения информации о кровотоке. Так, в зоне бифуркации обязательно имеет место расширение спектра скоростей и возможно появление составляющих с обратной скоростью вследствие нарушения ламинарного течения крови в месте разветвления сосуда.
В зоне изгиба сосуда наблюдаемый спектр скоростей расширяется, что в основном обусловлено изменением направления скоростей в месте изгиба и, следовательно, наличием составляющих скорости, направленных относительно оси датчика под разными углами.
Наблюдаемый спектр скоростей может расширяться вследствие того, что в пределах ширины ультразвукового луча находится участок сосуда, на протяжении которого условия оценки скорости кровотока меняются (рис. 10). Вблизи левой границы луча угол α между вектором скорости v и направлением на датчик отличается от угла α вблизи правой границы луча. Поэтому допплеровский сдвиг частоты, пропорциональный проекции скорости v·cosα, в левой и правой точках наблюдаемого участка сосуда также будет различным. В результате это воспринимается как расширение спектра скоростей.
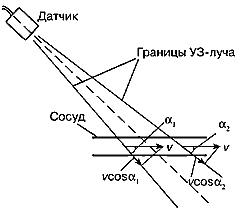
Рис. 10. Изменение величины проекции скорости в пределах ширины УЗ-луча.
На процесс получения данных о скоростях кровотока в области малых скоростей оказывает заметное влияние пульсация стенок сердца и стенок сосудов, возникающая в процессе смены систолической и диастолической фаз сердечного цикла. Движения стенок сосудов в процессе их периодического расширения и сужения дают дополнительные составляющие в спектр скоростей кровотока, и приходится принимать специальные меры для исключения этих составляющих, например выполнить фильтрацию соответствующих им частот допплеровского сдвига.
Напомним, что спектр скоростей кровотока может быть определен путем измерения спектра частот допплеровского сдвига у эхо-сигналов, отраженных элементами крови, в силу того, что оба спектра однозначно связаны между собой.
Рассмотрим более подробно методы спектральной допплеровской эхографии и способы реализации измерения допплеровского сдвига частоты и оценки спектра скоростей кровотока.
Непрерывноволновой допплер
Непрерывноволновой допплер (continuous wave Doppler — CW-Doppler) был первым и (на ранней стадии развития ультразвуковых допплеровских систем) единственным использовавшимся методом допплеровской эхографии. В режиме CW излучаются и принимаются синусоидальные сигналы большой длительности, которые поэтому называются непрерывными. На самом деле длительность эхо-сигналов, обрабатываемых в системе, ограничена во времени, что связано, в частности, с необходимостью измерения допплеровского сдвига частоты на конечных интервалах, не превышающих 5÷10 мс. В противном случае невозможно оценивать изменение спектра скоростей кровотока во времени на различных фазах сердечного цикла, т.е. не реализуется принцип измерения "в реальном времени".
Для режима CW используются специальные датчики, в которых излучение и прием обеспечивается отдельными ультразвуковыми преобразователями. На рис. 11а изображен двухэлементный CW-датчик так называемого карандашного типа (pencil probe). Излучатель и приемник датчика имеют вид пьезокерамических полудисков, акустически и электрически отделенных друг от друга. Излучатель формирует передающий луч, приемный преобразователь воспринимает приемный луч. Оси лучей ориентированы таким образом, чтобы они пересекались на некоторой глубине, в районе которой датчик должен исследовать сосуды.
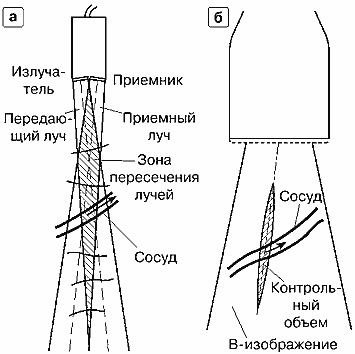
Рис. 11. Датчики для непрерывноволнового допплера.
Заштрихована рабочая зона датчика — контрольный объем,
а — карандашный датчик, б — дуплексный датчик.
На излучатель поступает непрерывный синусоидальный электрический сигнал с частотой f0 (рис. 12). В пьезокерамическом излучателе электрический сигнал преобразуется в синусоидальный ультразвуковой сигнал с той же частотой f0. Излучаемые ультразвуковые колебания, распространяющиеся вглубь биологических тканей, в основном сконцентрированы в границах передающего луча (рис. 11 а). По мере распространения ультразвуковые колебания претерпевают отражения от акустических неоднородностей [1], и часть этих отражений в виде эхо-сигналов возвращается к датчику и может быть принята его приемным преобразователем. Наилучшим образом прием эхо-сигналов осуществляется в границах приемного луча. Очевидно, что наиболее благоприятные условия исследования имеют место в зоне пересечения передающего и приемного лучей (на рис. 11 эта зона заштрихована).
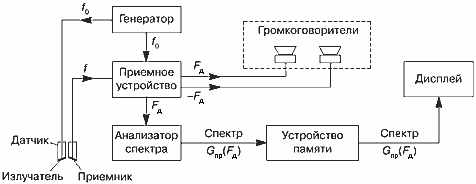
Рис. 12. Непрерывноволновой допплер. Схема и основные устройства систем излучения и обработки сигналов.
Область пересечения передающего и приемного лучей, в которой анализируется допплеровский спектр эхо-сигналов, называется контрольным объемом (sample volume).
Датчики карандашного типа используются в допплеровских приборах, в которых отсутствует В-режим, а также могут применяться как дополнительные датчики в ультразвуковых сканерах, в которых В-режим является основным.
В более совершенных ультразвуковых системах возможно использование дуплексных датчиков, работающих в В-режиме и CW-режиме (рис. 11.б). Это могут быть конвексные, линейные или фазированные датчики электронного сканирования. Приемный и передающий лучи в CW-режиме в этих датчиках формируются так же, как они формируются в В-режиме [1], с той только разницей, что для излучения и приема используются разные элементы матричного ультразвукового преобразователя. Это необходимо для уменьшения проникновения мощных излучаемых сигналов на вход приемника. В такого рода дуплексных датчиках можно уменьшить контрольный объем и, кроме того, не изменяя положения датчика на теле, менять направление луча (steering) для получения лучшего ракурса наблюдения кровотока. Важно, что при этом можно управлять направлением луча, наблюдая область исследования в виде двухмерного В-изображения.
Основной вклад в суммарный сигнал, принимаемый датчиком, работающим в CW-режиме, вносят эхо-сигналы от статичных (неподвижных) неоднородностей. Частота этих эхо-сигналов равна частоте излучаемого сигнала f0.
Если приемно-передающий луч датчика пересекает сосуд (рис. 11), в суммарном сигнале появляются составляющие с допплеровскими сдвигами частоты, пропорциональными проекциям скоростей элементов крови на направление к датчику. Таким образом, помимо эхо-сигналов с частотой f0 в суммарном сигнале содержатся эхо-сигналы с частотами f = f0 + Рд.
С выхода датчика принятый ультразвуковой сигнал, преобразованный приемником датчика в электрический сигнал, подается в приемное устройство (рис. 12), в котором сигнал усиливается и преобразуется таким образом, что на выходе остаются составляющие эхо-сигнала на частоте допплеровского сдвига частоты, т.е. с частотами Рд = f – f0. Одновременно определяется знак сдвига частоты: при положительном сдвиге кровоток принято называть прямым кровотоком, при отрицательном — обратным кровотоком.
С выхода приемного устройства сигналы поступают на анализатор спектра частот, о котором подробнее будет сказано ниже, и на громкоговорители. Обычно применяются два громкоговорителя: на один из них подаются допплеровские сигналы прямого кровотока, на другой — сигналы обратного кровотока. Выше было показано, что частоты допплеровского сдвига в основном лежат в диапазоне слышимых звуковых частот, поэтому они могут восприниматься человеческим ухом, будучи воспроизведены громкоговорителями. Наличие двух громкоговорителей дает возможность одновременно слышать из разных точек сигналы прямого и обратного кровотока. Очевидно, что это не имеет никакого отношения к стереозвучанию в аудиосистемах. Отметим также, что слышимые звуки частот допплеровского сдвига не имеют ничего общего с механическими шумами в сердце и сосудах, которые могут прослушиваться или записываться при фонокардиографии.
Сигналы с допплеровским сдвигом частоты после обработки в спектральном анализаторе запоминаются в устройстве памяти и потом в виде спектра частот допплеровского сдвига отображаются на дисплее прибора (рис. 12).
Отображение спектра частот допплеровского сдвига (рис. 8) позволяет сделать видимой на экране совокупность колебаний с различными частотами, которые можно слышать через громкоговорители.
Рассмотрим более подробно, как выглядит спектр частот допплеровского сдвига и как его принято отображать на дисплее прибора.
На рис. 13 показаны излучаемый и принимаемый сигналы, а также частотные спектры излучаемого и принимаемого сигналов. Излучаемый сигнал (рис. 13а) представляет собой протяженную во времени синусоиду с частотой fn. Поэтому его спектр (рис. 13.б) имеет вид очень узкого пика, центр которого расположен на оси частот в точке f0. Такой вид спектра говорит о том, что в сигнале имеется только одна частотная составляющая.
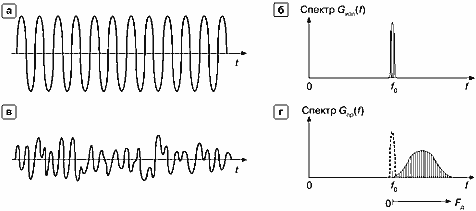
Рис. 13. Вид сигналов CW на временной оси и соответствующей вид спектра частот этих сигналов,
а — излучаемый сигнал, б — спектр излучаемого сигнала,
в — принимаемый эхо-сигнал, г— спектр принимаемого эхо-сигнала.
На рис. 13.в изображен вид принимаемого эхо-сигнала, отраженного от движущихся элементов крови в сосуде. Если бы все элементы двигались с одной и той же скоростью, то эхо-сигнал имел бы вид синусоиды с частотой f, отличной от f0 (как на рис. 13.г). Вследствие того, что элементы крови движутся с разными скоростями, отраженный сигнал имеет сложный вид, так как это сумма синусоид с разной частотой и разной амплитудой. Рисунок 13.г иллюстрирует вид частотного спектра этого сигнала. Спектр сигнала, отраженного неподвижными структурами, на рис. 13.г показан пунктиром. Он аналогичен спектру излучаемого сигнала.
Частотный спектр эхо-сигналов от движущихся элементов, или допплеровский спектр, сдвинут относительно частоты f0 вправо, если допплеровские сдвиги Рд положительны (случай прямого кровотока), или влево — если допплеровские сдвиги частот отрицательны (случай обратного кровотока). При турбулентном кровотоке часть спектра находится справа от f0, а часть — слева.
На рис. 13.г показано, как выглядит спектр эхо-сигнала на входе приемного устройства. На выходе приемного устройства те же сигналы имеют частоту допплеровского сдвига частоты, т.е. вид спектра остается тем же, но начало координаты частот переносится в точку f0.
На рис. 14 даны примеры спектров допплеровских сдвигов частоты. Изображены спектр излучаемого сигнала (рис. 14а), спектр эхо-сигналов в случае движения отражателей с одной и той же скоростью, спектр эхо-сигналов в случае прямого кровотока в сосуде (элементы движутся с различными скоростями). На этом же рисунке показан вид спектров обратного и турбулентного кровотоков.
Рис. 14. Примеры спектров частот допплеровского сдвига,
а — спектр частот излучаемого непрерывного сигнала (с ним по форме совпадает спектр эхо-сигналов от неподвижных отражателей),
б — спектр частот эхо-сигналов от отражателей, двигающихся с одной и той же скоростью,
в — спектр частот эхо-сигналов прямого кровотока,
г — спектр частот эхо-сигналов обратного кровотока,
д — спектр частот эхо-сигналов при турбулентном кровотоке.
Приведенные примеры характеризуют спектр на определенном интервале времени, достаточно коротком, чтобы можно было считать его неизменным. Такой спектр частот называется мгновенным спектром.
Врача-диагноста интересует изменение вида мгновенного спектра во времени. На рис. 15 сделана попытка изобразить вид спектра частот допплеровского сдвига (или спектра скоростей) в различные моменты времени t1, t2 и т.д. с помощью трехмерного графика. В отличие от рис. 14 здесь присутствует ось времени t, так что можно анализировать изменение спектра в зависимости от фаз сердечного цикла.
Рис. 15. Изменение спектра частот допплеровского сдвига во времени.
Как уже говорилось, на экране допплеровского прибора изменение спектра во времени изображают по-другому — в виде двухмерного графика зависимости допплеровского сдвига частот от времени (рис. 16).
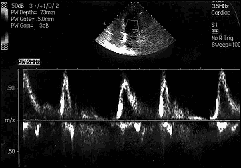
Рис. 16. Обычно используемое отображение меняющегося во времени спектра допплеровского сдвига в виде вертикальных полос с модуляцией яркости.
Уровень эхо-сигналов для различных частот при этом отображается в виде уровня яркости, соответствующей амплитуде эхо-сигналов. Как мы видим, используется такой же серошкальный (яркостный) метод, как и при построении акустических изображений в В-режиме. Чаще вместо значений частоты на оси допплеровских сдвигов частоты даются расчетные значения проекции скорости элементов кровотока. Тогда на дисплее отображается изменение во времени спектра скоростей кровотока (точнее, в данном случае, спектра проекций скоростей кровотока). Во многих случаях для диагностики абсолютные значения скорости не столь важны по сравнению с характером изменения во времени вида спектра скоростей.
В дуплексных ультразвуковых системах, где имеется возможность наблюдать двухмерное акустическое изображение, можно получить изображение сосуда, в сечении которого оценивается спектр частот допплеровского сдвига, и вычислить угол между осью сосуда и направлением на допплеровский датчик. Обычно эти вычисления производятся в приборе автоматически после выставления соответствующих маркерных линий по оси луча датчика и вдоль оси сосуда. Поэтому в таких приборах на временном графике спектра откладываются значения истинных скоростей кровотока.
Выше говорилось об отрицательном влиянии пульсаций стенок сердца и сосудов на наблюдаемый спектр скоростей кровотока. Это влияние проявляется в области малых скоростей кровотока (низких частот допплеровского сдвига). Для исключения из картины спектра составляющих, порождаемых пульсациями, применяются специальные фильтры пульсаций стенок сосудов (wall filter), которые не пропускают частоты допплеровского сдвига от нуля до некоторой максимальной частоты, равной, например, 80 или 120 Гц. Частота эта может изменяться в зависимости от того, какая частота датчика применяется, или в зависимости от типа наблюдаемого сосуда. При наблюдении кровотока в венах этот фильтр может вообще отключаться.
Когда фильтр включен, это хорошо видно на дисплее, так как в области малых скоростей (частот) возле линии нулевых скоростей имеют место темные полосы с обеих сторон (спектр не отображается).
Помимо пульсаций стенок сосудов дополнительное влияние на спектр частот эхо-сигналов оказывают физические причины. В силу очень малого размера отражающих элементов крови (эритроцитов) уровень отражаемых ими ультразвуковых сигналов тем больше, чем выше рабочая частота сигналов, излучаемых датчиком. Это приводит к некоторому смещению спектра частот эхо-сигналов (даже в отсутствие допплеровского сдвига) в сторону более высоких частот.
С другой стороны, вследствие частотнозависимого характера затухания ультразвуковых колебаний эхо-сигналы с большими частотами затухают сильнее, чем эхо-сигналы с малыми частотами. Это приводит к тому, что наблюдаемый спектр частот сдвигается в сторону несколько более низких значений скорости, тем больше, чем с большей глубины получены эхо-сигналы.
По временным спектральным характеристикам можно определить изменение во времени среднего значения скорости, а также максимального значения и изобразить их на дисплее (рис. 17).
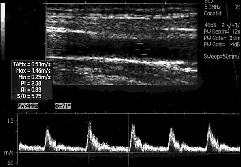
Рис. 17. Средняя и максимальная скорости кровотока и изменение их во времени.
В заключение рассмотрения метода непрерывноволнового допплера укажем его основные достоинства:
- хорошая чувствительность;
- возможность получить количественные характеристики кровотока, имеющие большую диагностическую информативность;
- высокая точность оценки спектра частот допплеровского сдвига и спектра скоростей кровотока;
- однозначность измерения допплеровских сдвигов частоты и, следовательно, спектра скоростей кровотока во всем диапазоне их возможных изменений;
- относительная простота технической реализации.
Недостатками метода являются:
- получение суммарной информации во всем диапазоне глубин без возможности выделения отдельных участков вследствие отсутствия разрешающей способности по глубине (большой по глубине контрольный объем);
- зависимость точности оценки спектра скоростей, а иногда и самой возможности оценки спектра от угла α между осью УЗ-луча и направлением кровотока (например — в случае α = 0 и за пределами критических углов оценка спектра невозможна);
- сложность работы для врача ввиду необходимости манипулирования датчиком и его ориентацией для того, чтобы в ультразвуковой луч датчика попал только один наблюдаемый сосуд и был выбран нужный угол наблюдения.
Области применения метода непрерывноволнового допплера — исследование кровотока в периферических сосудах, анализ атриовентрикулярного и аортального кровотока.
Импульсноволновой допплер
Основной недостаток метода непрерывноволнового допплера — отсутствие разрешающей способности по глубине — исключается в методе импульсноволнового допплера (Pulsed Wave Doppler — PW). Хорошо известно, что для получения двухмерного акустического изображения (В-эхограммы) в ультразвуковых сканерах используется излучение импульсных сигналов. При этом чем короче во времени импульсы, тем лучше разрешающая способность по глубине, или продольная разрешающая способность (longitudinal resolution) [1].
Рисунок 18 поясняет сказанное, изображая эхо-сигналы, отраженные от различных акустических неоднородностей (неподвижных — или статических, и движущихся — или динамических: кровоток в сосудах), для двух типов сигналов — длинных и коротких. Если ультразвуковой датчик излучает длинные импульсные сигналы S1(t), то отраженные эхо-сигналы зачастую накладываются друг на друга в тех случаях, когда отражатели находятся близко друг от друга: например, в случае 1 для неподвижных отражателей и в случае 2 для подвижных отражателей.
Если отражатель находится далеко от других (случай 3), зхо-сигнал от него воспринимается отдельно (рис. 18, ось 1). Принято говорить, что в случаях 1 и 2 отсутствует разрешение отражателей по глубине, а в случае 3 отражатель разрешается.
Естественно, когда излучаемый сигнал непрерывный (CW), то он занимает весь диапазон глубин так же, как и порождаемые им эхо-сигналы, и разрешение отражателей по глубине невозможно.
Если использовать короткий излучающий импульс S2(t), то эхо-сигналы, отраженные отдельными структурами в случаях 1 и 2, будут восприниматься раздельно на оси t (см. рис. 18, временная ось 2). Разрешающая способность по глубине здесь существенно выше, чем при сигнале S1(t). Однако очень близко расположенные отражатели, например — элементы крови в сосудах, отдельно по глубине не выделяются. Минимальный интервал по времени между элементами, при котором эхо-сигналы воспринимаются отдельно, равен длительности сигнала по времени t. Соответственно, минимальное расстояние по глубине между элементами, при котором они воспринимаются отдельно (разрешаются), равно: ΔL = С· t/2 [1].
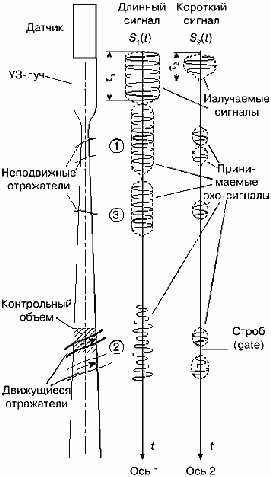
Рис. 18. Влияние длительности излучаемых сигналов на разрешающую способность по глубине: при длинном сигнале S1(t) разрешение хуже (ось 1), чем при коротком сигнале S2(t) (ось 2).
Для того чтобы наблюдать только один сосуд, необходимо выделить определенный интервал во времени — строб, или ворота (gate, или sample gate), и анализировать эхо-сигналы, приходящие в стробе. Положение этого интервала на оси времени t однозначно определяется глубиной расположения сосуда.
Если сосуд имеет большой диаметр, с помощью короткого импульса можно анализировать отдельные участки по толщине сосуда, устанавливая строб, равный длительности импульса, последовательно вдоль сечения сосуда (рис. 19) и получать характеристики скоростей кровотока в профиле сосуда.
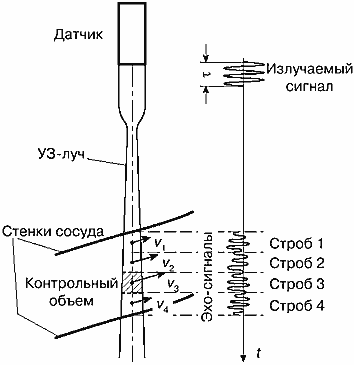
Рис. 19. При коротком сигнале возможно получение информации о скоростях кровотока на отдельных участках сечения крупного сосуда (в профиле сосуда).
Скорость измеряется отдельно на каждом участке в стробах 1, 2, 3 и 4.
Область, ограниченная шириной приемо-передающего УЗ-луча и длиной строба (рис. 18), характеризует контрольный объем в импульсноволновом допплере, т.е. ту область, в которой оценивается спектр скоростей кровотока. Длина и положение строба во времени (и следовательно, по глубине) однозначно связаны с размерами и положением контрольного объема. Поэтому зачастую вместо термина "строб" используется понятие "контрольный объем". В начале исследования, например в тех случаях, когда ведется поиск сосуда, длина строба может выбираться в несколько раз больше длины импульса. При этом строб по глубине может иметь размер 5÷10 мм. Соответственно и контрольный объем, т.е. область анализа зхо-сигналов, достаточно велик.
При исследовании скоростей в профиле сосуда или в локальной области сердца величина строба выбирается минимальной — почти равной или несколько большей, чем длина импульса излучения. В этом случае контрольный объем минимален (рис. 19), и, последовательно передвигая строб по глубине, можно анализировать спектр скоростей в каждом из малых объемов.
Приведенные примеры наглядно иллюстрируют тот факт, что для измерения допплеровских сдвигов частоты на отдельных интервалах по глубине целесообразно применять короткие импульсные сигналы. Это утверждение требует существенного уточнения. Дело в том, что при использовании коротких сигналов получается гораздо более низкая точность измерения допплеровского сдвига частоты, чем при длинных сигналах.
Зто объясняется, во-первых, тем, что короткие импульсы имеют соответственно более низкий уровень энергии, и, следовательно, всегда присутствующие шумы и помехи в большей степени затрудняют измерение сдвига частоты.
Во-вторых, снижение точности обусловлено тем, что с уменьшением длительности сигнала расширяется соответствующий ему спектр частот. При этом затрудняется измерение малых допплеровских сдвигов частоты, величина которых меньше ширины спектра частот сигнала. Более подробно это разъясняется в следующих разделах.
Поэтому для измерения допплеровских сдвигов частоты применяются не просто короткие импульсные сигналы, а периодические последовательности импульсов, или так называемые пачки импульсов. Использование пачки коротких импульсов позволяет устранить упомянутые недостатки, так как энергия пачки возрастает с увеличением количества импульсов, а спектр становится более узким. Таким образом, пачка импульсов позволяет сохранить основные достоинства длинного сигнала, позволяющего с достаточной точностью измерять допплеровский сдвиг частоты. С другой стороны, пачка коротких импульсов дает возможность обеспечить ту же разрешающую способность по глубине, что и один короткий импульс.
На рис. 20.а показан длинный синусоидальный сигнал, из которого формируется пачка импульсов (рис. 20.б) путем вырезания коротких сигналов длительностью τи каждый, отстоящих друг от друга на интервал Т. Интервал Т называется периодом повторения импульсов. Обратная величина F = 1/T называется частотой повторения импульсов (pulse repetition frequency — PRF). Это очень важная характеристика импульсных допплеровских сигналов, о которой еще будет сказано ниже.
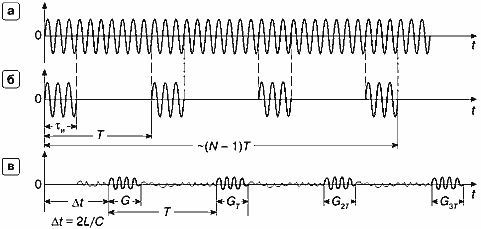
Рис. 20. Импульсноволновой допплер. а — сигнал генератора с частотой f0.
б — сформированная пачка из N импульсов с периодом повторения Т.
в — пачка эхо-импульсов, отраженных от движущихся структур;
G, GT, G2T, С3T — стробы, в которых осуществляется прием эхо-сигналов с глубины L.
Схема и основные устройства подсистемы излучения и обработки сигналов в системе импульсноволнового допплера показаны на рис. 21.
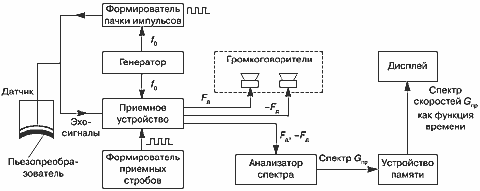
Рис. 21. Импульсноволновой допплер. Схема и основные устройства системы излучения и обработки сигналов.
Пачка импульсов образуется из непрерывного сигнала генератора с частотой f0 при помощи формирователя пачки и подается на пьезопреобразователь датчика, в котором электрические сигналы трансформируются в механические колебания ультразвуковой частоты и излучаются в направлении, определяемом формой луча датчика. Этот же пьезопреобразователь служит и для приема отраженных эхо-сигналов. В этом принципиальное отличие датчиков для импульсноволнового допплера от датчиков для непрерывноволнового допплера, где для излучения и приема используются отдельные пьезопреобразователи.
Принятые датчиком акустические эхо-сигналы преобразуются им в электрические и поступают на приемное устройство (рис. 21). Эхо-сигнал от каждого отражающего элемента биологических структур также представляет собой пачку импульсов, сдвинутую (запаздывающую) по времени относительно излученной пачки на время Δt = 2L/C, где L — глубина отражателя относительно поверхности датчика (рис. 20.в). Когда элементарных отражателей много и они близко расположены друг относительно друга (что имеет место при обследовании биологических структур), эхо-сигналы от них образуют непрерывный шумоподобный сигнал, в котором трудно выделить импульсные эхо-сигналы, соответствующие одному элементу. Для этого прием осуществляется в стробах, обозначенных на рис. 20.в буквами G, GT, G2T и т.д. Стробы устанавливаются со сдвигом во времени относительно каждого из излучаемых импульсов пачки на величину Δt = 2L/C, при этом временной интервал между соседними стробами равен Т.
Как уже было сказано, глубина L соответствует ожидаемому расположению обследуемого объекта, например сосуда или части его сечения. Формирование приемных стробов является функцией одного из устройств системы (рис. 21). После выделения эхо-сигнала его частота сравнивается с частотой f0 генератора, и если эхо-сигнал обязан своим происхождением движущимся структурам (кровотоку), то выделяются составляющие эхо-сигнала с частотами допплеровского сдвига Рд (положительными или отрицательными). Эхо-сигналы на частоте допплеровского сдвига поступают на два громкоговорителя: один для положительных, другой для отрицательных сдвигов частоты. Эти же эхо-сигналы подаются на анализатор спектра, вычисляющий спектр частот допплеровского сдвига GПР(Fд). Спектр запоминается в устройстве памяти и отображается на дисплее прибора (рис. 21) в виде картинки, аналогичной показанной на рис. 16.
Предположим теперь, что отражающая структура находится не на глубине L, a на глубине L1 = L + ТС/2, т.е. на временном расстоянии от начала оси времени, равном (Δt + Т) (рис. 22).
Рис. 22. Неоднозначность определения глубины отражающих структур в системах импульсноволнового допплера.
а — пачка излучаемых импульсов, б — пачка принимаемых сигналов.
Это означает, что импульсы пачечного эхо-сигнала попадут в ворота GT, G2T и т.д. Система импульсноволнового допплера обнаружит эти импульсы и воспримет их также, как эхо-сигналы от структуры на глубине L, и будет измерять их спектр частот допплеровского сдвига. При этом система не в состоянии определить точно — на какой же действительно глубине L или L1 находится отражающая структура, т.е. имеет место неоднозначность измерения глубины. Происходит это в тех случаях, когда первый эхо-импульс приходит позже, чем датчиком излучается второй импульс пачки.
Если движущиеся отражающие структуры (например, сосуды) находятся одновременно на глубинах L и L1, то система будет измерять некий суммарный допплеровский спектр, т.е. давать заведомо неверный результат.
Для того чтобы не было неоднозначности определения глубины, необходимо выполнение следующего условия для величины периода повторения импульсов в пачке: Т > 2Lmax/C , где Lmax — максимальная глубина, в пределах которой мы хотим обеспечить однозначные измерения.
Кстати, это требование всегда выполняется в режиме В, где тоже в процессе сканирования периодически излучаются короткие импульсы, правда, в отличие от режима импульсноволнового допплера — в разных направлениях (лучах).
Стремление выполнить требование однозначного измерения глубины в системах импульсноволнового допплера приходит в противоречие с требованием однозначного определения допплеровского сдвига частоты. Об этом подробнее рассказывается ниже.
Сигналы и их спектры
Особенности допплеровских измерений спектра скоростей движения биологических структур довольно трудны для понимания. Вот почему в этом разделе даются некоторые начальные сведения о характеристиках сигналов, использующихся для допплеровских измерений. Эти сведения известны инженерам, участвующим в разработке, производстве и эксплуатации ультразвуковых приборов, но врачи — пользователи аппаратуры с этой информацией знакомы, как правило, недостаточно хорошо.
На рис. 23 (слева) представлены основные виды сигналов, используемых в ультразвуковых диагностических системах.
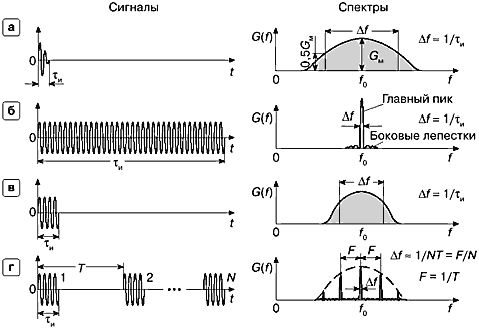
Рис. 23. Вид сигналов, используемых в ультразвуковой диагностике (слева), и соответствующих им амплитудно-частотных спектров (справа). Сигналы и их спектры связаны между собой преобразованием Фурье,
а — В-режим,
б — CW-режим,
в — PW-режим — одиночный импульс,
г — PW-режим — пачка из N импульсов.
Эти сигналы излучаются датчиками, а получаемые в результате отражения в тканях эхо-сигналы принимаются теми же датчиками и далее усиливаются и преобразуются в системе. Каждый из сигналов может быть представлен в виде суммы синусоидальных (гармонических) колебаний с различными частотами, амплитудами и фазами. Такое представление называется спектром сигнала. Спектр характеризует распределение интенсивности сигнала по частотам, т.е. определяет, какие частотные составляющие представлены больше или меньше в сигнале. Спектр — очень важная характеристика сигнала и связана с временным видом сигнала взаимно-однозначной зависимостью. Если известен вид сигнала, то спектр сигнала может быть вычислен с помощью так называемого преобразования Фурье. И наоборот — зная амплитудно-фазовый спектр, можно определить вид сигнала на оси времени путем вычисления обратного преобразования Фурье. Естественно, принимаемые эхо-сигналы также характеризуются спектром, который может быть вычислен с помощью преобразования Фурье. В допплеровских ультразвуковых системах, предназначенных для оценки спектра скоростей кровотока, принятые эхо-сигналы подвергаются обработке в специальных процессорах, вычисляющих преобразование Фурье, т.е. оценивающих спектр эхо-сигналов. Для ускорения вычислений применяется специальный алгоритм — быстрое преобразование Фурье (БПФ, или FFT — fast fourier transform).
Рассмотрим импульсный сигнал, используемый для получения двухмерного серошкального изображения в В-режиме (рис. 23.а). Длительность этого сигнала τи очень мала, что обусловлено стремлением получить хорошее продольное разрешение. Амплитудный спектр G(f) этого сигнала, напротив, очень широкий. Вообще для сигналов простой формы существует четкая связь между длительностью сигнала τи и шириной его спектра Δf: чем короче импульс, тем шире его спектр, и наоборот, чем длиннее сигнал, тем уже спектр. Ширина спектра (по уровню 0,5 от максимума спектра GM) приближенно равна Δf = 1/τи
В реально используемых датчиках сигналы в В-режиме имеют ширину спектра Δf не менее 40÷50% от центральной частоты f0. Например, при работе с датчиком 3,5 МГц (f0 = 3,5 МГц), ширина спектра — не менее 1,4 МГц. Длительность сигнала τи при этом не более 0,7 мкс. В современных системах все чаще используются сигналы с еще более широким спектром частот, что обеспечивает высокую разрешающую способность.
В допплеровских системах с CW-режимом используется очень длинный синусоидальный сигнал на одной частоте f0 (рис. 23.б). Спектр этого сигнала чрезвычайно узкий и сосредоточен в очень малой области частот около f0. Например, если длительность сигнала 10 мс, то ширина спектра сигнала Δf = 100 Гц. Таким образом, в CW-режиме применяются сигналы с существенно меньшей шириной спектра, чем в В-режиме. Это имеет решающее значение для точности измерения допплеровского спектра частот.
Основным недостатком режима непрерывно-волнового допплера, как уже говорилось, является отсутствие разрешающей способности по глубине. Поэтому в режиме PW — альтернативном методе оценки допплеровского спектра, применяются импульсные сигналы, длительность которых существенно меньше, чем в режиме CW, но несколько больше, чем в режиме В (рис. 23.в). Ширина спектра такого одиночного импульса хоть и меньше, чем в режиме В, но слишком велика, чтобы обеспечить измерение спектра частот допплеровского сдвига с таким же качеством, как в режиме CW. Поэтому в режиме PW применяется пачка импульсов, спектр которой имеет специфический вид, называемый "гребенчатой функцией" (рис. 23.г). Вместо одного явно выраженного максимума спектр пачечного сигнала имеет много пиков. Ширина каждого из узких пиков одна и та же и определяется длительностью пачки из N импульсов: Δf = 1/(NT) .
Если длительность пачки равна длительности сигнала в режиме CW, то ширина каждого пика спектра пачечного сигнала в этом случае равна ширине единственного пика спектра сигнала CW. Расстояние F между отдельными пиками на оси частот равно частоте повторения импульсов (PRF).
Уровень отдельных пиков различен и определяется огибающей (пунктирная линия на рис. 23.г), которая в точности повторяет форму спектра одиночного импульса пачки (рис. 23.в).
Измерение спектра частот допплеровского сдвига. Однозначность измерения
Рассмотрев вид сигналов и их спектров, мы можем теперь пояснить, как влияет вид сигнала (или его спектра) на качество измерения спектра частот допплеровского сдвига.
Предположим, что нам известен спектр скоростей кровотока в сечении сосуда G(v) и известна ориентация сосуда относительно датчика, т.е. угол α. Мы можем вычислить теперь спектр частот допплеровского сдвига G(f), используя уже известные нам соотношения:
| Gист(f) = f0 | 2G(v) cosα |
|---|---|
| C |
Вычисленный таким образом спектр частот допплеровского сдвига назовем истинным спектром, так как предполагается, что он измерен без всяких ошибок, которые всегда имеются в реальных условиях измерения.
На рис. 24.а дан пример спектра Gист(f) для прямого кровотока.
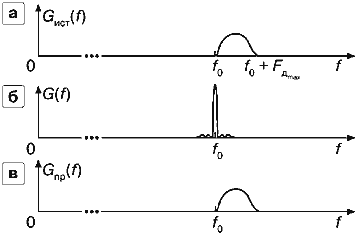
Рис. 24. Измерение спектра частот допплеровского сдвига в режиме CW.
а — истинный спектр,б — спектр излучаемого непрерывного сигнала,
в — вид спектра частот, получаемого на выходе приемного тракта (измеряемый спектр) — форма спектра практически повторяет вид истинного спектра частот допплеровского сдвига.
В режиме CW спектр излучаемого сигнала, как уже говорилось, очень узкий (рис. 24.б), т.е. излучается практически одна частота f0. Поэтому спектр частот эхо-сигналов кровотока на выходе датчика очень близок к истинному спектру частот допплеровского сдвига Gист(f). Некоторые отличия могут быть связаны с тем, что приемно-передающий ультразвуковой луч датчика не бесконечно узкий, поэтому принимаются сигналы в некотором объеме сосуда, а не в одном сечении — что может приводить к расширению спектра по сравнению с истинным. Если это расширение незначительно и уровень эхо-сигналов достаточен, чтобы уверенно наблюдать их на фоне мешающих шумов и помех, то измеренный спектр частот допплеровского сдвига практически повторит по форме истинный спектр (рис. 24.в).
Попытка использовать для измерения спектра частот допплеровского сдвига одиночный короткий импульс обречена на неудачу, так как такому импульсу соответствует широкий спектр частот, существенно превышающий по ширине истинный спектр частот допплеровского сдвига (сравним рис. 25.а и 24.а). Спектр частот на выходе приемного тракта в основном повторяет форму спектра излучаемого сигнала (см. рис. 25.б).
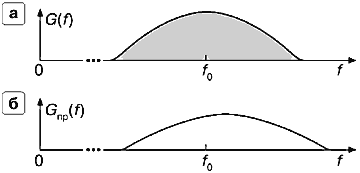
Рис. 25. Измерение спектра частот допплеровского сдвига с помощью одиночного короткого импульса (истинный спектр показан на рис. 24а).
а — спектр излучаемого сигнала,
б — спектр частот на выходе приемного тракта — форма спектра почти повторяет форму спектра сигнала и не имеет ничего общего с истинным спектром кровотока.
Физический смысл результата понятен: каждой из частотных составляющих сигнала, а не только частоте f0, соответствует спектр частот допплеровского сдвига, и если просуммировать все эти спектры, то и получим широкий спектр частот, не имеющий почти ничего общего с оцениваемым истинным спектром.
Можно пояснить полученный результат с помощью простой образной аналогии — полагая, что мы желаем нарисовать известный нам истинный спектр частот допплеровского сдвига на рис. 24.а с помощью фломастеров различной толщины.
В случае непрерывноволнового допплера мы для этого имеем тонкий фломастер с шириной линии, равной ширине спектра непрерывного сигнала на рис. 24.б. Поэтому рисунок спектра на рис. 24.б очень похож на истинный спектр.
В случае одиночного импульса фломастер слишком толст (ширина его линии равна ширине спектра сигнала на рис. 25.а) для того, чтобы изобразить тонкий рисунок истинного спектра.
В режиме PW, когда излучается пачечный сигнал, спектр излученного сигнала имеет многопиковый характер и ширина каждого пика очень узкая. Если истинный спектр частот допплеровского сдвига имеет относительно малую ширину (рис. 26.а), так что ширина его не превышает частоты повторения импульсов F (рис. 26.б) — то измерение спектра частот допплеровского сдвига возможно. Измеренный спектр при этом также получается многопиковым (рис. 26.в), хотя соответствует истинному спектру только та часть полученного в результате спектра, которая ограничена определенным интервалом измерения, в пределах от (f0 – F/2) до (f0 + F/2), где F — частота повторения импульсов. На рис. 26.в правильно измеренный спектр показан сплошной линией, а ложные измерения — пунктиром.
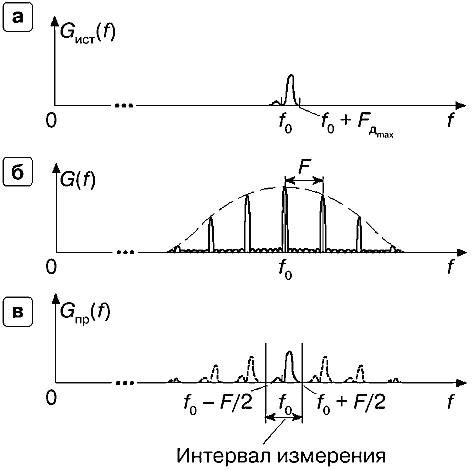
Рис. 26. Измерение спектра частот допплеровского сдвига в режиме PW при малой ширине истинного спектра,
а — истинный спектр частот допплеровского сдвига с положительными и отрицательными составляющими,
б — спектр излучаемой пачки импульсов с малой частотой повторения F.
в — полученный спектр на выходе приемника — форма спектра оценивается однозначно в интервале измерения.
Опять поясним физический смысл полученного результата: в отличие от непрерывноволнового допплера, когда излучается практически одна частота f0, при импульсноволновом допплере излучаются, кроме нее, составляющие с частотами f0 + F, f0 – F, f0 + 2F, f0– 2F и т.д. Каждая из этих частот порождает свой спектр частот допплеровского сдвига в соответствии с вышеприведенными соотношениями.
Возвращаясь к аналогии с рисунком фломастером, можно сказать, что в режиме импульсно-волнового допплера мы имеем несколько тонких фломастеров, жестко связанных между собой (гребенку фломастеров). Рисуя центральным из них истинный спектр, мы вынужденно повторяем другими фломастерами ту же картину, но со сдвигом по оси частот вправо и влево.
Появление в этом случае ложных изображений спектра (aliasing-эффект), т.е. возможная неоднозначность измерения спектра частот допплеровского сдвига, является серьезным недостатком, присущим импульсноволновому допплеру.
Интервал однозначного измерения истинного спектра частот допплеровского сдвига ограничен диапазоном (–F/2, +F/2) относительно несущей частоты f0 излучаемого сигнала. Поэтому в режиме PW очень важен правильный выбор F — частоты повторения импульсов излучаемой пачки.
Действительно в примере, приведенном на рис. 26, при малой ширине измеряемого (истинного) спектра, в интервале измерения (–F/2, +F/2) спектр измеряется правильно. Если же ширина истинного спектра выходит за пределы интервала измерения, можно получить совершенно неправильную оценку истинного спектра. На рис. 27 изображен такой случай. Видно, что при ширине спектра, большей, чем частота повторения F, спектр на выходе приемника сильно искажен, так как на истинный спектр накладываются сдвинутые ложные картины того же спектра, т.е. опять имеет место aliasing-эффект. В результате определить истинный спектр невозможно. Это происходит вследствие малой частоты повторения F по сравнению с шириной оцениваемого спектра частот допплеровского сдвига.
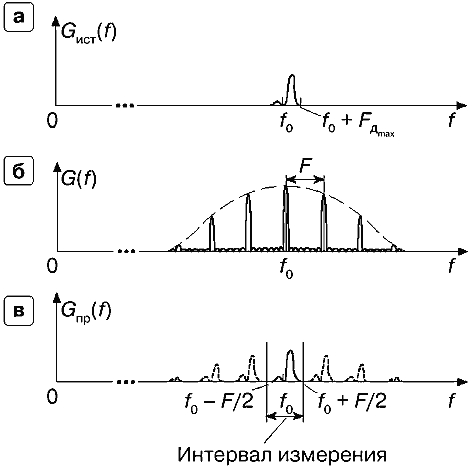
Рис. 27. Измерение спектра частот допплеровского сдвига в режиме PW.
a — истинный спектр с большой шириной полосы,
б — спектр излучаемой пачки импульсов с малой частотой повторения F.
в — спектр на выходе приемника — имеет место искажение формы истинного спектра и неопределенность направления кровотока.
Если увеличить частоту повторения F, то можно избежать наложения ложных картинок спектра на истинную (рис. 28). При этом форма спектра не искажена, однако имеет место неопределенность направления кровотока. В самом деле, при анализе спектра невозможно определить, какой из спектров соответствует истинному - в интервале (f0, fp + F) или в интервале (f0 - F, f0). Обе кривые могут вместе соответствовать турбулентному кровотоку, т.е. случаю одновременного наблюдения прямого и обратного кровотоков.
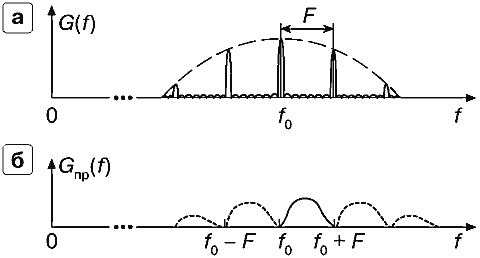
Рис. 28. Измерение спектра частот допплеровского сдвига в режиме FW (истинный спектр показан на рис. 27.а).
а — спектр излучаемой пачки импульсов со средней частотой повторения F.
б — спектр на выходе приемника — форма спектра не искажена, имеет место неопределенность направления кровотока.
Для того чтобы решить задачу однозначной оценки истинного спектра в этом случае, надо еще более увеличить частоту F, т.е. перейти к высокой частоте повторения импульсов (режим HPRF — high pulse repetition frequency). В этом случае возможно практически однозначное измерение истинного спектра частот допплеровского сдвига (рис. 29).
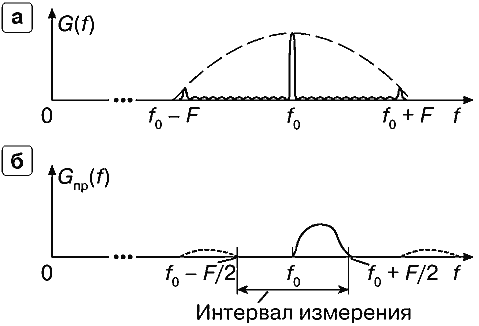
Рис. 29. Измерение спектра частот допплеровского сдвига в режиме PW (истинный спектр показан на рис. 24.а).
а — спектр излучаемой пачки импульсов с высокой частотой повторения F.
б — спектр на выходе приемника — форма спектра не искажена, в интервале измерения спектр и направление кровотока оцениваются однозначно.
Приведенные примеры дают возможность пояснить условие однозначного измерения спектра частот допплеровского сдвига, известное как критерий Найквиста: FДmax ≤ F/2 , которое означает, что максимальная частота допплеровского сдвига FДmax в спектре (рис. 24.а, 26.а и 27.а) должна быть не более половины частоты повторения.
Стремление выполнить зто требование для самого широкого спектра частот допплеровского сдвига или для самого большого ожидаемого допплеровского сдвига частоты приводит к тому, что может не выполняться условие однозначного определения глубины отражателей, о котором говорилось выше, Т > 2Lmax/C .
Имея в виду, что Т = 1/F, можно переписать последнее неравенство F < C/(2Lmax)
Тогда условие одновременного однозначного измерения допплеровского спектра и глубины можно представить в виде одного неравенства FДmax < C/(4Lmax) .
Из этого неравенства следует, что чем большую ширину допплеровского спектра частот мы хотим однозначно измерить, тем в меньшем диапазоне глубин это можно сделать, чтобы не было неоднозначности определения глубины отражающих структур.
И наоборот, если мы хотим увеличить диапазон однозначно определяемых глубин, мы вынуждены пойти на уменьшение максимальной величины допплеровского сдвига частоты.
Если использовать ранее приведенные соотношения, которые по величине допплеровского сдвига частоты позволяют определить проекцию скорости кровотока в направлении на датчик, то можно написать условие однозначного измерения скорости кровотока и глубины
| v ≤ | C2 |
|---|---|
| 8f0Lmax |
На рис. 30 это условие показано графически для различных частот датчика: 2, 4 и 8 МГц. Для низкой частоты f0 = 2 МГц возможность однозначного измерения скоростей и глубин имеется в очень широком диапазоне их практических значений. На рис. 30 это область, находящаяся ниже кривой 1.
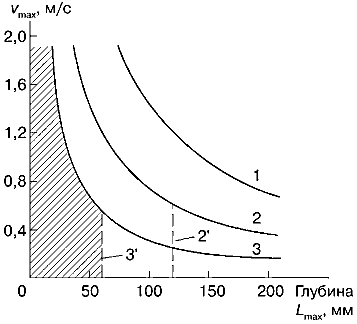
Рис. 30. Условие однозначного измерения одновременно глубины и скорости кровотока для различных частот датчиков при импульсноволновом допплере (FW).
1 — f0= 2 МГц,
2 — f0= 4 МГц,
3 — f0= 8 МГц,
2', 3' — границы области однозначных измерений для f0 = 4 МГц и f0 = 8 МГц.
При частоте f0 = 4 МГц область однозначных измерений (ниже кривой 2) уменьшается. Дополнительно она уменьшается еще и по причине ослабления чувствительности на этой частоте и, следовательно, снижения предельных глубин, на которых можно получать различимый допплеровский эхо-сигнал. Для f0 = 4 МГц эти глубины обычно не более 120 мм. Граница области, определяемая необходимой чувствительностью, обозначена на рис. 30 пунктирной линией 2'.
При частоте датчикаf0= 8 МГц область однозначности сужается еще более и дополнительно уменьшается диапазон рабочих глубин до предельных значений 60 мм (пунктирная линия 3"). На рис. 30 область однозначных измерений для частоты f0= 8 МГц заштрихована. За пределами этой области измерения возможны, но с трудностями, связанными с появлением грубой ошибки измерения скорости или неточным определением глубины сосуда (рис. 31).
Рис. 31. Пример неоднозначности измерения спектра.
Перечислим основные достоинства метода импульсноволнового допплера:
- наличие разрешающей способности по глубине, что позволяет выделять отдельные малые участки для оценки скорости кровотока (малые контрольные объемы);
- достаточно высокие чувствительность и точность оценки количественных диагностически значимых характеристик кровотока;
- простое совмещение режима PW с режимом В в ультразвуковых сканерах и реализация дуплексного режима работы В + D.
Недостатки метода импульсноволнового допплера:
- возможность неоднозначного измерения спектра скоростей и, вследствие этого, появления искажения спектра скоростей (aliasing-эффект);
- неоднозначность определения глубины контрольного объема при больших частотах повторения импульсов (режим HPRF) и, как следствие, получение мешающей дополнительной информации;
- зависимость оценки спектра скоростей от угла между осью УЗ-луча и направлением кровотока (аналогично методу непрерывноволнового допплера).
Практические измерения и вычисления в режиме спектральной допплеровской эхографии
Особенности проведения исследований в допплеровских режимах в существенной степени определяются характеристиками используемого прибора. Конкретные указания на этот счет содержатся в инструкции по эксплуатации прибора (Operation Manual). Инструкция не может охватить все многообразие встречающихся на практике случаев, и здесь решающее значение имеет опыт врача, а также знание основных физических принципов работы в допплеровском режиме, о которых даются сведения в этой главе.
В приборах "слепого" допплера (где отсутствует В-режим) необходимо хорошее знание расположения сосудов для направления ультразвукового луча на интересующий сосуд и отстройки от всех других сосудов, находящихся рядом.
В дуплексных системах, когда имеется возможность визуализировать нужный сосуд на двухмерном изображении, работа существенно облегчается. Однако и здесь могут возникать некоторые трудности. Так, если используются дуплексные датчики механического секторного сканирования, надо иметь в виду, что они не обеспечивают одновременную работу в режиме В и допплеровском режиме. Сначала поиск сосуда ведется по двухмерному изображению, и после установки курсорной линии в нужном направлении вдоль сечения сосуда включается допплеровский режим (CW или PW). При этом режим В отключается, и требуется держать датчик в нужном направлении, корректируя, если надо, его положение точно также, как и в приборах "слепого" допплера.
Если используются дуплексные датчики электронного сканирования (линейные, конвексные и фазированные секторные), то таких проблем не возникает, так как при включении после В-режима допплеровского режима режим В время от времени включается для того, чтобы исследователь мог наблюдать двухмерное изображение и с его помощью корректировать положение датчика. Указанная особенность датчиков электронного сканирования обусловлена практически мгновенным переходом из одного режима в другой, что невозможно сделать в датчиках механического сканирования в силу инерционности сканирующего пьезопреобразователя.
Основной сложностью при работе в режиме импульсноволнового допплера является выбор таких характеристик системы, при которых исключается или хотя бы уменьшается влияние эффекта неоднозначности определения спектра частот допплеровского сдвига или неоднозначности по глубине. Для этого полезно сначала примерно оценить возможную ширину спектра частот допплеровского сдвига (или спектра скоростей) в зоне исследования с тем, чтобы правильно выбрать частоту повторения импульсов. В современных приборах обычно может выбираться нужный диапазон измеряемых скоростей кровотока, в соответствии с которым устанавливается необходимая частота повторения.
Очень важно правильно интерпретировать получаемую в режиме импульсноволнового допплера информацию о спектре с тем, чтобы научиться определять случаи некорректного (вследствие неоднозначности) измерения спектра частот допплеровского сдвига и спектра скоростей.
Если вид спектра представляется искаженным, т.е. наблюдаются артефакты, свидетельствующие о неоднозначности, то можно использовать один из следующих способов, уменьшающих или устраняющих неоднозначность измерения спектра.
- Уменьшение проекции скорости путем изменения наклона датчика по отношению к оси сосуда.
- Использование более низкой частоты излучения датчика за счет смены датчика на более низкочастотный или переключения рабочей частоты датчика на более низкую (если датчик многочастотный).
Оба способа имеют общий недостаток, связанный с уменьшением точности измерения спектра допплеровских скоростей.
- Сдвиг базовой линии. Этот способ позволяет увеличить диапазон однозначного определения части спектра частот допплеровского сдвига (положительной или отрицательной) за счет уменьшения диапазона измерения другой части (соответственно, отрицательной или положительной).
- Увеличение частоты повторения импульсов (установление режима HPRF) или, что то же самое, увеличение диапазона измеряемых скоростей. Этот способ используется наиболее часто — для этого в современных приборах есть возможность быстро изменять частоту повторения импульсов. Однако необходимо помнить о том, что увеличение частоты повторения импульсов влечет за собой уменьшение интервала однозначного определения глубины. Это приводит к тому, что помимо истинного строба по глубине, который выставлен на интересующий исследователя сосуд, появляются дополнительные стробы по глубине, в которых также может измеряться спектр частот. В дуплексных приборах, когда имеется возможность наблюдать на экране прибора двухмерное изображение, основной строб обычно отображается в виде сплошных отрезков, а дополнительные (фантомные) стробы — в виде пунктирных отрезков. Надо следить за тем, чтобы дополнительные стробы не попали на другие сосуды. В противном случае оценка спектра будет неправильной!
- Радикальный способ устранения неоднозначности измерений — использование режима непрерывноволнового допплера. Этот способ возможно применять, если в приборе есть помимо импульсноволнового допплера и непрерывноволновой допплер. При этом следует иметь в виду, что в режиме непрерывноволнового допплера отсутствует разрешающая способность по глубине и возникает трудность выделения нужного сосуда, а также отсутствует возможность измерять спектр в отдельных частях сечения сосуда.
Одним из преимуществ допплеровских методов ультразвуковой диагностики является возможность получения количественной диагностически значимой информации об исследуемых движущихся структурах. Основные измерения связаны с анализом спектра скоростей (или частот допплеровского сдвига), в частности с определением максимальной систолической скорости, конечной (минимальной) диастолической скорости, а также средней скорости кровотока.
На основе измерений этих скоростей (или частот) вычисляются параметры (индексы), преимуществом которых является то, что они, как правило, не зависят от допплеровского угла.
Наиболее часто используются следующие параметры:
Систоло-диастолическое отношение — СД (peak systolic to end diastolic ratio — SDR). Этот параметр вычисляется как отношение максимальной систолической скорости кровотока А и конечной диастолической скорости В (рис. 32): СД=А/В .
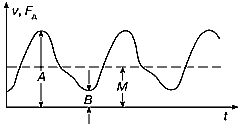
Рис. 32. К вычислению диагностических параметров по измеренным значениям скоростей (частот) на спектрограмме.
А — максимальная систолическая скорость,
В — конечная диастолическая скорость,
М — средняя скорость.Индекс резистентности (сопротивления) — ИР (Resistance Index — RI). Вычисляется на основе измерения тех же значений скоростей (частот кровотока) А и В (рис. 32): ИР = (А-В)/А .
Пульсационный индекс — ПИ (Pulsatility Index — PI). Рассчитывается на основе измерений значений А и В, а также средней скорости кровотока М (рис. 32): ПИ = (А-В)/М .
Перечисленные индексы в существенной мере зависимы друг от друга (коррелированы), поэтому в различных случаях может использоваться тот или другой из них.
Процент стеноза — ПС (Percentage Stenosis). Обычно используется для оценки степени сужения сосуда (артерии). Вычисляется в процентах на основе измерений максимальных скоростей в сосуде в зоне, предшествующей стенозу VПС, и в самой зоне стеноза VС (рис. 33): ПС = (VПС/VС) ·100% .
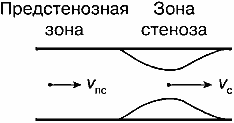
Рис. 33. Вычисление степени стеноза по результатам измерения максимальных скоростей в предстенозной зоне и зоне стеноза.С помощью допплеровских измерений могут вычисляться и другие количественные характеристики, например: градиент давления, время ускорения потока, время замедления потока, интеграл линейной скорости, ударный обьем, площадь митрального отверстия, обьемный кровоток, почечно-аортальный индекс.
Перечисленные, а также многие другие параметры и характеристики определяются с помощью специализированных программ — кардиологических и ангиологических. Подробные сведения об этих и других характеристиках можно найти в инструкциях по эксплуатации приборов.
Цветовое допплеровское картирование
Для режима цветового допплеровского картирования (Color Flow Mapping — CFM) используются также обозначения CFI (Color Flow Imaging), CDV (Color Doppler Visualization) и CDI (Color Doppler Imaging).
Цветовое допплеровское картирование в основе своей строится аналогично серошкальному (черно-белому) изображению, получаемому в обычных ультразвуковых сканерах, не использующих допплеровскую информацию. Принципиальным отличием режима CFM является то, что в определенной (выделенной) части серошкального изображения выводится в цвете информация о скорости движения структур в каждом из элементов изображения.
Для этого, как и в обычном сканере, в отдельных направлениях датчик излучает ультразвуковые импульсы и принимает эхо-сигналы, приходящие с различных глубин. Глубина отражающих структур определяется по времени прихода импульса, так как скорость движения импульса в мягких тканях почти неизменна. Яркость отметки на экране, соответствующей эхо-сигналу, пропорциональна амплитуде сигнала. Все сказанное относится к случаю отражений от неподвижных структур.
Кровоток в серошкальном В-режиме, как правило, отображается плохо, прежде всего из-за недостаточного уровня отраженных от элементов крови эхо-сигналов. В режиме CFM более высокая энергия излучаемых сигналов позволяет наблюдать эхо-сигналы от элементов крови.
В эхо-сигналах, отраженных движущимися структурами, появляется допплеровский сдвиг частоты, т.е. частота эхо-сигналов изменяется относительно частоты сигнала, отражаемого неподвижными структурами (рис. 34).
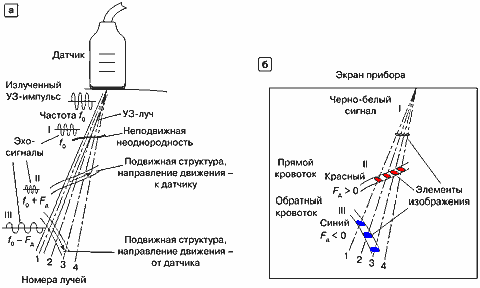
Рис. 34. Принципы формирования цветового допплеровского изображения,
а — вид эхо-сигналов, отраженных неподвижной (I) и подвижными (II и III) структурами,
б — вид на экране прибора элементов изображения, соответствующих эхо-сигналам I, II, III.В каждом элементе изображения, в котором имеет место допплеровский сдвиг частоты эхо-сигнала, аппаратура определяет знак этого сдвига (положительный или отрицательный) и среднее значение частоты сдвига.
По измеренному среднему значению допплеровского сдвига частоты, зная или оценивая допплеровский угол, можно вычислить среднее значение скорости движения в элементе. Направление и среднее значение скорости в ряде случаев можно вычислить и прямым измерением без использования допплеровских методов. В соответствии с направлением скорости элемент изображения окрашивается в красные или синие тона. При этом изменения цвета от темно-красного до красного, оранжевого и желтого отображают возрастающую величину среднего значения скорости для прямого кровотока. Для обратного кровотока в зависимости от величины сдвига цвет меняется от почти черного, темно-фиолетового до голубого, иногда зелено-голубого и зеленого. Обычно цветовая палитра дается в качестве справочной на экране цветного монитора прибора рядом с акустическим изображением.
В некоторых приборах отображаются не только направление и среднее значение скорости кровотока в анализируемом элементе, но и ширина спектра скоростей в этом элементе. Один из способов отображения — изменение насыщенности цвета; при этом к основному цвету подмешивается белый цвет тем в большей пропорции, чем больше ширина спектра скоростей.
На рис. 35 дана структурная схема системы цветового допплеровского картирования, которая содержит устройства, обеспечивающие получение двухмерного изображения: формирователь ультразвукового луча, управление сканированием и сканконвертер. Кроме того, в систему обязательно входят те же устройства, что и в систему импульсноволнового допплера (а иногда и непрерывноволнового допплера), включая анализатор спектра и громкоговорители.
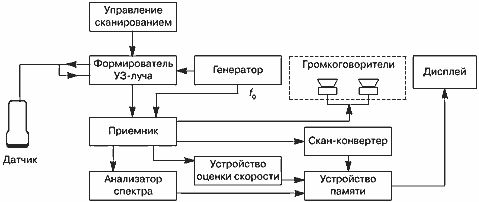
Рис. 35. Цветовое допплеровское картирование (режим CFM).
Схема и устройства системы излучения и обработки сигналов.Специфическим узлом системы цветового допплеровского картирования является устройство оценки скорости, назначение которого — измерять направление и среднюю величину допплеровского сдвига частоты в элементах анализируемой области. Иногда это же устройство оценивает ширину спектра скоростей в каждом элементе.
Датчики, применяемые для цветового допплеровского картирования, аналогичны датчикам, используемым в сканерах с черно-белым изображением. Отличием их является то, что они могут работать в дуплексном режиме, т.е. одновременно в режимах В и CFM. В силу этого технология их изготовления обеспечивает высокую чувствительность при приеме допплеровских сигналов.
С учетом необходимости получать с помощью датчиков не только серо-шкальное изображение, но и допплеровскую информацию, работа с датчиками в режиме CFM имеет свои особенности.
При неблагоприятной ориентации оси ультразвукового луча датчика относительно скорости движения v (например, скорости кровотока в сосуде), когда они перпендикулярны друг другу, проекция скорости движения на ось луча равна нулю и частота эхо-сигнала от движущихся структур f равна частоте f0, излучаемой датчиком, т.е. допплеровский сдвиг частоты Fд = 0 (рис. 36). В этом случае оценить скорость движения невозможно.
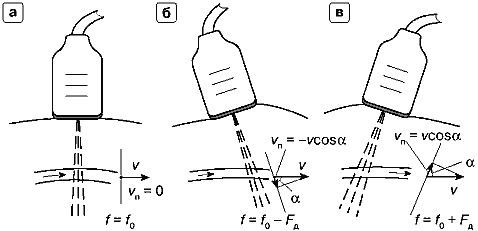
Рис. 36. Возможность оценки скорости кровотока в зависимости от взаимной ориентации датчика и сосуда,
а — направление излучения-приема секторного датчика перпендикулярно направлению движения кровотока — измерение скорости невозможно.
б — изменение ориентации датчика позволяет измерить проекцию скорости кровотока — допплеровский сдвиг частоты FД отрицателен,
в — другая ориентация датчика относительно того же сосуда — сдвиг частоты FД положителен.Один из способов, который позволяет решить задачу оценки скорости движения в этой ситуации — изменение ориентации оси датчика относительно направления движения в ту или другую сторону (рис. 36.б или З6.в). В этом случае проекция скорости на ось ультразвукового луча имеет отрицательное или положительное направление относительно датчика, и возможно определение этой проекции скорости по измеренному значению допплеровского сдвига частоты Fд. Такой способ можно применять, когда используется датчик с малой апертурой (размером рабочей поверхности), например секторный датчик (механического или электронного сканирования) или микроконвексный датчик.
Если применяется линейный датчик или конвексный датчик с большой апертурой (большим размером рабочей поверхности), затруднительно изменять ориентацию датчика простым наклоном в ту или иную сторону, так как при этом может быть нарушен контакт рабочей поверхности датчика с поверхностью тела. Один из возможных способов решения проблемы — изменение направления излучения-приема (steering) относительно рабочей поверхности датчика (рис. 37). Указанный способ усложняет аппаратуру, однако эффективно решает проблему оценки скорости в неблагоприятных ситуациях.
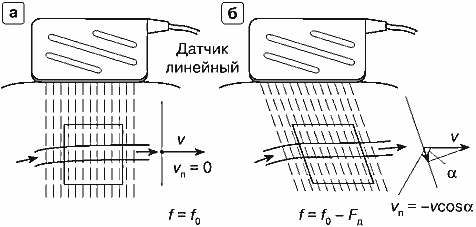
Рис. 37. Изменение направления излучения-приема (steering),
a — неблагоприятный ракурс наблюдения.
б — изменение ракурса наблюдения — допплеровский угол α ≤ 90°.Режим цветового допплеровского картирования (CFM) принципиально отличается от режимов спектрального допплера (CW или PW) прежде всего тем, что должен обеспечить оценку скорости кровотока сразу во многих элементах изображения, причем в реальном времени, т.е. с частотой кадров не менее 15÷20 с–1.
Для измерения скорости в режиме CFM используется пачечный сигнал, похожий на сигнал, применяемый в режиме PW. Однако общая длительность сигнала и число импульсов в пачке в режиме CFM существенно меньше. На это имеются следующие причины:
- Дефицит времени. Для того чтобы наблюдать достаточно представительную зону в режиме CFM, надо излучить пачечный сигнал в процессе сканирования последовательно по крайней мере в нескольких десятках соседних направлений (ультразвуковых лучей). Например, если число направлений 20, то для реализации частоты кадров 20 с–1 необходимо иметь длительность пачки сигналов не более 1,5÷2 мс.
- Ограниченное число цветов или оттенков, которые может воспринимать исследователь на экране дисплея и при этом мысленно соотносить каждому цвету определенное значение скорости кровотока. Число таких цветов, определяющее разрешающую способность по скорости в режиме CFM, как правило, не более 8 для одного направления, т.е. общее число не более 16. Большее количество цветовых оттенков иногда используется в более сложных и дорогих приборах.
По указанным причинам количество импульсов в пачке в режиме CFM — от 8 до 24, т.е. много меньше, чем в режиме PW, где требуется более точная шкала измерения спектра скоростей.
Для оценки скоростей в режиме CFM не используется процессор быстрого преобразования Фурье (FFT), как в режимах PW и CW, а применяется один из двух методов обработки сигналов:
- фазовый метод — как правило, на базе процессора автокорреляционной обработки (phase-domain system);
- метод измерения временных сдвигов с применением кросскорреляционной обработки (time-domain system).
Первый метод использует допплеровский принцип измерения скоростей. Второй основан на прямом измерении изменения положения совокупности движущихся отражателей (например, эритроцитов) на заданном интервале времени, после чего скорость их движения вычисляется простым делением пройденного пути на интервал времени. Изменение положения отражателей определяется по дополнительному временному сдвигу, возникающему в соседних импульсах пачки (рис. 38). Если совокупность отражателей за время Т изменила свое положение вследствие движения со скоростью v· cosα по направлению к датчику, то интервал между эхо-сигналами будет меньше, чем период Т между излучаемыми импульсами на величину ΔТ. Измерив величину ΔТ = (vTcosα)/C , можно оценить скорость движения отражателей.
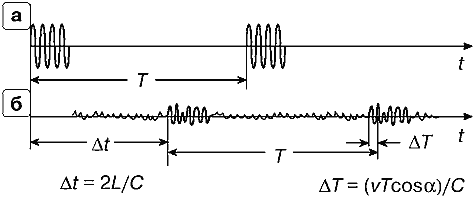
Рис. 38. Оценка скорости движения методом измерения временных сдвигов с применением корреляционной обработки,
а — излучаемые импульсы пачки с периодом Т.
б — принимаемые эхо-сигналы от движущейся структуры: второй эхо-импульс приходит не через период Т относительно первого эхо-импульса, а немного раньше из-за движения структуры к датчику со скоростью v· cosα
(L — глубина расположения движущейся структуры).Эхо-сигналы от движущихся структур на практике не имеют четких границ, подобных тем, которые показаны на рис. 38. Поэтому из всей совокупности эхо-сигналов с интервалом Т между ними выделяются наиболее похожие друг на друга и между ними измеряется временной сдвиг. "Похожесть" сигналов определяется с помощью алгоритма кросскорреляционной обработки.
Режим CFM позволяет наблюдать двухмерную картину распределения кровотока в области анализа в быстром темпе — с частотой смены кадров не менее 10÷15 с–1. Это условие наблюдения в реальном времени фаз сердечного цикла. Однако частая смена кадров и быстрое изменение скоростей кровотока затрудняют восприятие динамической информации, так как при этом могут ускользать диагностически значимые детали изображения.
Поэтому в большинстве современных приборов, использующих режим CFM, имеется возможность запоминать ряд последовательно получаемых кадров (не менее нескольких десятков) с тем, чтобы потом их просматривать в более медленном темпе. Такой способ запоминания и просмотра кадров называется кинопамятью (cine memory, или cine loop). Обычно запись кадров сопровождается синхронной регистрацией с отображением на экране прибора кривой ЭКГ, получаемой с одного отведения. Синхронизация с кривой ЭКГ позволяет при последующем просмотре точно привязывать каждый кадр к определенной фазе сердечного цикла.
Достоинство режима CFM по сравнению с режимами спектрального допплера очевидно: возможность в реальном времени наблюдать двухмерную картину кровотока одновременно в достаточно большой зоне, отображая информацию о средних скоростях (а иногда и о ширине спектра скоростей) в каждом отдельном элементе изображения.
Недостатки режима CFM:
- те же недостатки, которые присущи методам спектрального допплера и связаны с зависимостью оценки скорости от угла между осью УЗ-луча и направлением кровотока, а также недостаток, общий с режимом PW — появление искажений и ошибок оценки средней скорости вследствие неоднозначности (aliasing-эффект),
- получение в основном качественной информации о скоростях кровотока в отличие от методов спектрального допплера, где возможна оценка количественных характеристик.
Вследствие того, что режим цветового допплеровского картирования в современных приборах обязательно сочетается с режимами спектрального допплера (PW и часто CW), это дает возможность использовать все достоинства этих режимов.
Практика работы в режиме цветового допплеровского картирования
В системе с режимом CFM появляется необходимость в дополнительных процедурах управления по сравнению с режимом В и режимом спектрального допплера.
После выбора наиболее подходящего для исследователя ракурса наблюдения в режиме В осуществляется переключение в режим CFM. При этом необходимо выбрать расположение, размер и форму цветового окна (color window). В зависимости от типа датчика цветовое окно может иметь форму прямоугольника (параллелограмма) — для линейных датчиков, или сектора — для секторных и конвексных датчиков. Выбирается диапазон глубин цветового окна и его ширина (линейная или угловая).
Управление усилением (gain) обеспечивает необходимый уровень амплитуд принимаемых эхо-сигналов.
Выбор цвета (color map selection) и инверсия цвета (color inversion) — позволяют выбрать наиболее удобную палитру цветов для отображения всего диапазона наблюдаемых скоростей.
Фильтр стенок сосудов (wall filter) дает возможность устранить в цветном изображении нежелательные составляющие в спектре частот допплеровского сдвига, вызванные влиянием движения стенок кровеносных сосудов или сердца. При выборе предельной частоты фильтра надо быть очень осторожным, чтобы не исключить вместе с вредными составляющими полезную информацию о кровотоке с малой скоростью. При анализе венозного кровотока фильтр может быть вообще отключен.
Сглаживание (smoothing) и усреднение кадров (frame averaging) в зависимости от установленного уровня обеспечивают более или менее мягкое (сглаженное) цветное изображение путем заполнения пустых (пропущенных) элементов изображения за счет соседних элементов и использования в каждом новом кадре информации из прежних кадров. При повышении уровня усреднения кадров качество изображения улучшается, но уменьшается реальный темп обновления информации, что может затруднить исследование быстро меняющихся процессов (например, при наблюдении кровотока в сердце).
Диапазон скоростей (color velocity range), отражаемых в цвете, изменяется путем выбора частоты повторения импульсов (PRF) также, как при спектральном допплере. Уменьшение диапазона (снижение частоты повторения) дает возможность отображать малые скорости кровотока, но может привести к появлению артефактов вследствие неоднозначности оценки больших скоростей кровотока. Поэтому следует очень аккуратно выбирать диапазон скоростей.
Артефакты, возникающие из-за неоднозначности измерения скорости (aliasing) и глубины, являются наиболее часто встречающимся явлением, мешающим получению правильной информации в режиме CFM, точно так же, как и в режиме PW. Причины, порождающие эти артефакты, похожи, так как в обоих режимах применяются периодические пачечные импульсные сигналы. Поэтому для режима CFM можно использовать те же соотношения, определяющие условия однозначного измерения, которые были приведены выше для характеристики режима импульсноволнового допплера.
В качестве примера можно привести таблицу максимальных значений одновременно однозначно измеряемых скорости и глубины.
Таблица Рабочая
частота
датчика,
МГцМаксимальная
проекция
скорости
(v · cosα), см/сМакси-
мальная
глубина,
смЧастота
повторения
импульсов,
кГц3 50 20 4 100 10 8 200 5 16 5 75 8 10 150 4 20 300 2 40 В тех случаях, когда условия однозначного измерения скорости или глубины не выполняются, могут иметь место грубые ошибки в оценке картины распределения скоростей кровотока.
Развитие допплеровских методов
В начале 90-х годов были разработаны и позднее появились в продаже приборы с новыми допплеровскими технологиями, которые позволили существенно расширить сферы применения допплеровских методов.
Энергетическая допплеровская эхография, или энергетический допплер (PD — power Doppler); в англоязычной литературе имеется несколько синонимов: color angio, ultrasound angiography, color Doppler energy (CDE), color power angio (CPA), power flow (PW).
Рис. 39. Пример PD.Этот режим является модификацией режима цветового допплеровского картирования и отличается от него тем, что позволяет отображать двухмерную картину расположения и формы сосудов, выделяя их одним цветом на фоне обычного изображения в В-режиме. Метод энергетического допплера не дает информацию о средней скорости кровотока в отдельных элементах изображения, а регистрирует факт наличия кровотока. В этом смысле он близок методу рентгеновской ангиографии и позволяет наблюдать сосуды со слабым кровотоком, такие как сосуды почек, яичек, плаценты и т.д. Оттенки цвета (как правило, с переходом от темно-оранжевого к оранжевому и желтому) несут информацию об интенсивности сигналов, отраженных движущимися элементами крови (рис. 39). Основные преимущества метода: меньшая зависимость от допплеровского угла, повышенная чувствительность и большая частота кадров по сравнению с другими допплеровскими методами. Более подробная информация об этом методе дана в [5].
Допплеровская визуализация тканей (DTI — Doppler Tussue Imaging, или TSI — Tissue Specific Imaging).
Рис. 40. Пример изображения при допплеровской визуализации тканей.
Двухмерный (вверху) и одномерный (внизу) режимы.Метод используется для регистрации движения тканей, например миокарда, путем отображения на двухмерной картине пространственного распределения скоростей движения отдельных элементов тканей тем же способом, что при цветовом допплеровском картировании. Принципиальное отличие метода состоит в том, что если при цветовом допплеровском картировании с помощью фильтров исключаются эхо-сигналы от стенок сердца и сосудов, то при допплеровской визуализации тканей, наоборот — исключается информация о кровотоке и регистрируется только движение тканей.
Возможны различные режимы отображения информации о движении тканей: картирование относительной скорости и направления движения тканей; картирование ускорения (изменения во времени скорости); картирование уровня энергии эхо-сигналов от движущихся тканей. Области применения метода включают прежде всего исследования физиологической функции миокарда.
Конвергентный цветовой допплер (CCD — Convergent Color Doppler). Метод, объединяющий возможности цветового допплеровского картирования и энергетического допплера. Если уровень эхо-сигналов от элементов кровотока выше определенного порога, то отображается информация о скорости кровотока, как в обычном режиме CFM. Информация о кровотоке с малым уровнем эхо-сигналов (ниже порога) отображается также, как в режиме энергетического допплера.
Возможны другие модификации метода конвергентного допплера, когда для сильных эхо-сигналов на двухмерной картине дополнительно отображается информация об энергии отраженных сигналов или во всем диапазоне сигналов отображается информация об энергии сигналов и направлении кровотока.
Кинетическое изображение (KI — Kinetic Image, или СК — Color Kinesis). Метод не является допплеровским, но используется в цветовых допплеровских системах, позволяя выделять цветом границы движущихся тканей (например, стенок сосудов) и наблюдать траекторию их движения во времени за счет отображения "следа" движения границ. При этом положения границы в последовательные моменты времени кодируются различным цветом или оттенками цвета.
Трехмерное цветовое допплеровское картирование. Метод, называемый иногда режимом 4D, так как предполагается, что трехмерная картина распределения скоростей должна наблюдаться во времени. Этот метод находится в начальной стадии развития из-за трудностей, связанных с острым дефицитом времени, необходимым для получения информации. Выше мы говорили о том, что для двухмерного цветового картирования трудно получить частоту кадров более 15÷20 с–1.
Для трехмерного картирования необходимо дополнительно получить не менее 20÷30 кадров в процессе перемещения плоскости сканирования по третьей координате. Следовательно, время получения трехмерного массива данных может составлять секунду или более. Это слишком большой интервал, так как картина распределения скоростей будет искаженной вследствие того, что отдельные кадры в трехмерном массиве будут соответствовать различным фазам сердечного цикла.
Существуют способы преодоления указанного недостатка, однако ценой потери качества информации (например, способ уменьшения зоны обзора или способ параллельного приема сразу несколькими ультразвуковыми лучами). Если указанные принципиальные трудности будут преодолены, метод трехмерного цветового картирования займет достойное место среди других методов.
Трехмерная энергетическая допплеровская эхография, или трехмерная ультразвуковая ангиография. Этот метод не позволяет отображать информацию о скоростях кровотока в сосудах — так же, как и двухмерный энергетический допплер, метод регистрирует только факт наличия кровотока. В результате сканирования по двум координатам можно получать трехмерную (пространственную) картину расположения и формы сосудов и отображать ее на плоском экране в изометрическом (псевдотрехмерном) виде. Меняя ракурс наблюдения, т.е. поворачивая трехмерное изображение сосудов, можно получить достаточно полное представление о пространственном расположении и форме сосудов. Метод уже реализован в серийно выпускаемых приборах.
Диагностическая значимость и области применения перечисленных методов уточняются в процессе проведения клинических исследований.
Литература
- Осипов Л. В. Физика и техника ультразвуковых диагностических систем // Медицинская визуализация. 1997. № 1. С. 6-14; № 2. С. 18-37; № 3. С. 38-46; № 4. С. 42-53. 1998. № 1. С. 28-33; № 2 (в печати).
- Kremkau F.W. Doppler ultrasound: principles and instruments. 2nd ed. Philadelphia; L. etc.: W.B. Saunders Co., 1995. P. 373.
- Advances in ultrasound techniques and instrumentation / Ed. by Wells P.NT.; N.Y.; Edinburgh; L. etc.: Churchill Livingstone Inc., 1993. P. 19.
- Physics in Medical Ultrasound / Ed. by Evans I.A. L: Institute of Physical Sciences in Medicine, 1986. Report № 47. P. 184.
- Митьков В.В., Зыкин Б.И., Буланов М.Н. Ультразвуковая ангиография // Медицинская визуализация. 1996. №2. С. 4-13.




